第87页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
9. 将6g含有$CH_{4}$(甲烷)和$H_{2}$的混合气体完全燃烧,把产生的气体通入足量的澄清石灰水中(反应生成碳酸钙沉淀和水),得到20g白色沉淀。原混合气体中$CH_{4}和H_{2}$的质量比为(
A.$2:3$
B.$3:10$
C.$8:1$
D.$8:7$
D
)A.$2:3$
B.$3:10$
C.$8:1$
D.$8:7$
答案:
D 解析:设6 g原混合气体中甲烷的质量为x。由CH₄+2O₂$\stackrel{点燃}{=}$CO₂+2H₂O、Ca(OH)₂+CO₂=CaCO₃↓+H₂O可得关系式:CH₄~CaCO₃16 100x 20 g$\frac{16}{100}=\frac{x}{20\ g}$ x=3.2 g则原混合气体中CH₄和H₂的质量比为3.2 g:(6 g-3.2 g)=8:7。
10. 取20.0g$KMnO_{4}$固体制氧气,加热一段时间后,固体质量减少1.6g。已分解的$KMnO_{4}的质量占取用的KMnO_{4}$总质量的百分比为(
A.$8\%$
B.$39.5\%$
C.$79\%$
D.$92\%$
C
)A.$8\%$
B.$39.5\%$
C.$79\%$
D.$92\%$
答案:
C
11. 已知:$2Na_{2}O_{2}+2CO_{2}\xlongequal{}2Na_{2}CO_{3}+O_{2}$。在真空密闭容器中,将13.2g$CO_{2}与一定质量的Na_{2}O_{2}$固体充分反应后,收集到气体M的质量为x g。下列说法正确的是(
A.若$x= 4.8$,气体M中含有$CO_{2}$
B.若$x= 4.8$,生成的$Na_{2}CO_{3}$的质量为15.9g
C.若$x= 7.6$,$Na_{2}O_{2}$反应后可能有剩余
D.若$x= 7.6$,气体M中$CO_{2}与O_{2}的质量比为11:8$
D
)A.若$x= 4.8$,气体M中含有$CO_{2}$
B.若$x= 4.8$,生成的$Na_{2}CO_{3}$的质量为15.9g
C.若$x= 7.6$,$Na_{2}O_{2}$反应后可能有剩余
D.若$x= 7.6$,气体M中$CO_{2}与O_{2}的质量比为11:8$
答案:
D 解析:设恰好完全反应时参加反应的Na₂O₂的质量为a,生成碳酸钠的质量为b,生成氧气的质量为c。2Na₂O₂+2CO₂=2Na₂CO₃+O₂156 88 212 32a 13.2 g b c$\frac{156}{88}=\frac{a}{13.2\ g}$ a=23.4 g$\frac{212}{88}=\frac{b}{13.2\ g}$ b=31.8 g$\frac{32}{88}=\frac{c}{13.2\ g}$ c=4.8 g由上述计算可知,若x=4.8,则二氧化碳恰好完全反应,气体M中不含有CO₂,A的说法错误。若x=4.8,则生成的Na₂CO₃的质量为31.8 g,B的说法错误。若x=7.6,设反应生成氧气的质量为m,参加反应的二氧化碳的质量为n。2Na₂O₂ + 2CO₂ = 2Na₂CO₃ + O₂88 32n m气体质量减少量88-32=5613.2 g-7.6 g=5.6 g$\frac{32}{56}=\frac{m}{5.6\ g}$ m=3.2 g$\frac{88}{56}=\frac{n}{5.6\ g}$ n=8.8 g由上述计算可知,反应过程中二氧化碳有剩余,则Na₂O₂已经完全反应,C的说法错误。若x=7.6,其中含有氧气的质量为3.2 g,二氧化碳的质量为7.6 g-3.2 g=4.4 g,气体M中CO₂与O₂的质量比为4.4 g:3.2 g=11:8,D的说法正确。
12. 利用新型催化剂可将二氧化碳和氢气合成甲醇,甲醇的化学式为$CH_{3}OH$。试计算:
(1)甲醇中碳、氢、氧三种元素的质量比是
(2)生成128g甲醇需消耗二氧化碳的质量是
(1)甲醇中碳、氢、氧三种元素的质量比是
3:1:4
(填最简整数比)。(2)生成128g甲醇需消耗二氧化碳的质量是
176 g
。
答案:
(1)3:1:4
(2)176 g
(1)3:1:4
(2)176 g
13. (2024·广安)碱石灰($CaO和NaOH$)常用作气体的干燥剂。化学兴趣小组为测定某种碱石灰中$CaO$的质量分数,将10g碱石灰加入80g$Na_{2}CO_{3}$溶液中,发生反应:$CaO+H_{2}O+Na_{2}CO_{3}\xlongequal{}CaCO_{3}+2NaOH$。待碱石灰中$CaO$完全反应后,测得生成$CaCO_{3}$固体的质量为10g。
(1)除去$CaCO_{3}$固体后,所得溶液的质量为
(2)求该碱石灰中$CaO$的质量分数。(写出计算过程)
(1)除去$CaCO_{3}$固体后,所得溶液的质量为
80
g。(2)求该碱石灰中$CaO$的质量分数。(写出计算过程)
答案:
(1)80
(2)解:设该碱石灰中CaO的质量分数为x。CaO +H₂O+Na₂CO₃=CaCO₃↓+2NaOH56 10010 g·x 10 g$\frac{56}{100}=\frac{10\ g·x}{10\ g}$ x=56%答:该碱石灰中CaO的质量分数为56%。
(1)80
(2)解:设该碱石灰中CaO的质量分数为x。CaO +H₂O+Na₂CO₃=CaCO₃↓+2NaOH56 10010 g·x 10 g$\frac{56}{100}=\frac{10\ g·x}{10\ g}$ x=56%答:该碱石灰中CaO的质量分数为56%。
14. (2023·牡丹江改编)兴趣小组同学做了氢氧化钠溶液和硫酸铜溶液反应的定量实验。向192g硫酸铜溶液中逐滴加入氢氧化钠溶液,所加氢氧化钠溶液的质量与生成沉淀的质量关系如图所示,生成的硫酸钠全部溶解。
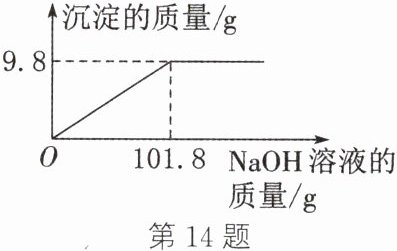
(1)恰好完全反应时,生成沉淀的质量为
(2)请计算硫酸铜溶液中硫酸铜的质量。
(3)请计算恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率。

(1)恰好完全反应时,生成沉淀的质量为
9.8
g。(2)请计算硫酸铜溶液中硫酸铜的质量。
(3)请计算恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率。
(2)设192 g硫酸铜溶液中硫酸铜的质量为x,生成硫酸钠的质量为y。CuSO₄+2NaOH=Cu(OH)₂↓+Na₂SO₄160 98 142x 9.8 g y$\frac{160}{98}=\frac{x}{9.8\ g}$ x=16 g$\frac{98}{142}=\frac{9.8\ g}{y}$ y=14.2 g
(3)恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率为$\frac{14.2\ g}{192\ g+101.8\ g-9.8\ g}×100\% =5\%$。答:
(2)硫酸铜溶液中硫酸铜的质量为16 g。
(3)恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率为5%。
(3)恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率为$\frac{14.2\ g}{192\ g+101.8\ g-9.8\ g}×100\% =5\%$。答:
(2)硫酸铜溶液中硫酸铜的质量为16 g。
(3)恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率为5%。
答案:
(1)9.8 解:
(2)设192 g硫酸铜溶液中硫酸铜的质量为x,生成硫酸钠的质量为y。CuSO₄+2NaOH=Cu(OH)₂↓+Na₂SO₄160 98 142x 9.8 g y$\frac{160}{98}=\frac{x}{9.8\ g}$ x=16 g$\frac{98}{142}=\frac{9.8\ g}{y}$ y=14.2 g
(3)恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率为$\frac{14.2\ g}{192\ g+101.8\ g-9.8\ g}×100\% =5\%$。答:
(2)硫酸铜溶液中硫酸铜的质量为16 g。
(3)恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率为5%。
(1)9.8 解:
(2)设192 g硫酸铜溶液中硫酸铜的质量为x,生成硫酸钠的质量为y。CuSO₄+2NaOH=Cu(OH)₂↓+Na₂SO₄160 98 142x 9.8 g y$\frac{160}{98}=\frac{x}{9.8\ g}$ x=16 g$\frac{98}{142}=\frac{9.8\ g}{y}$ y=14.2 g
(3)恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率为$\frac{14.2\ g}{192\ g+101.8\ g-9.8\ g}×100\% =5\%$。答:
(2)硫酸铜溶液中硫酸铜的质量为16 g。
(3)恰好完全反应时,所得溶液中硫酸钠质量占所得溶液质量的百分率为5%。
查看更多完整答案,请扫码查看


