第77页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
6. (2024·宜宾)某反应的微观示意图如图。下列说法错误的是(
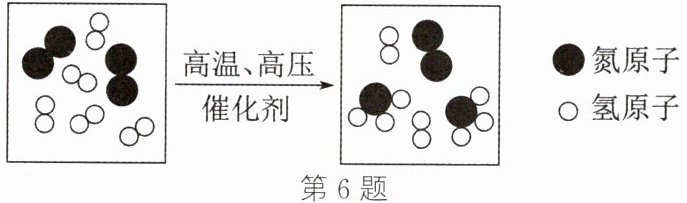
A.“ ”对应物质的化学式为 $ {NH_{3}} $
”对应物质的化学式为 $ {NH_{3}} $
B.该反应前后原子总数不变
C.该反应前后分子总数不变
D.参加该反应的“ ”与“
”与“ ”的个数比为 $ 1:3 $
”的个数比为 $ 1:3 $
C
)
A.“
 ”对应物质的化学式为 $ {NH_{3}} $
”对应物质的化学式为 $ {NH_{3}} $B.该反应前后原子总数不变
C.该反应前后分子总数不变
D.参加该反应的“
 ”与“
”与“ ”的个数比为 $ 1:3 $
”的个数比为 $ 1:3 $
答案:
C
7. 某校课外兴趣小组的同学用氯酸钾和二氧化锰的混合物加热制取氧气,实验结束时发现固体混合物的质量减少了。请用学过的化学知识解释:
根据质量守恒定律,参加反应的氯酸钾的质量等于反应后生成的氯化钾和氧气的质量总和,因为生成的氧气是气体,一部分被收集起来,还有一部分逸散到空气中,所以固体混合物的质量减少了(合理答案均可)
。
答案:
根据质量守恒定律,参加反应的氯酸钾的质量等于反应后生成的氯化钾和氧气的质量总和,因为生成的氧气是气体,一部分被收集起来,还有一部分逸散到空气中,所以固体混合物的质量减少了(合理答案均可)
8. 下列变化遵守质量守恒定律的是(
A.石墨制成金刚石
B.$ 2\ {g}\ {H_{2}} $完全燃烧生成 $ 36\ {g}\ {H_{2}O} $
C.水变成汽油
D.冰转化成干冰
A
)A.石墨制成金刚石
B.$ 2\ {g}\ {H_{2}} $完全燃烧生成 $ 36\ {g}\ {H_{2}O} $
C.水变成汽油
D.冰转化成干冰
答案:
A
9. 铜制品长期暴露在空气中,表面会生成铜锈[主要成分为 $ {Cu_{2}(OH)_{2}CO_{3}} $],下列物质一定与铜制品生锈无关的是(
A.$ {N_{2}} $
B.$ {O_{2}} $
C.$ {H_{2}O} $
D.$ {CO_{2}} $
A
)A.$ {N_{2}} $
B.$ {O_{2}} $
C.$ {H_{2}O} $
D.$ {CO_{2}} $
答案:
A
10. (2024·绥化)现将 $ 40\ {g}\ {A} $和足量的 $ {B} $混合加热。$ {A} $与 $ {B} $发生化学反应,$ 40\ {g}\ {A} $完全反应后生成 $ 32\ {g}\ {C} $和 $ 22\ {g}\ {D} $,则参加反应的 $ {B} $与生成的 $ {D} $的质量变化比是(
A.$ 20:7 $
B.$ 7:11 $
C.$ 5:4 $
D.$ 16:11 $
B
)A.$ 20:7 $
B.$ 7:11 $
C.$ 5:4 $
D.$ 16:11 $
答案:
B 解析:40g A完全反应后生成32g C和22g D,由质量守恒定律可知,参加反应的B的质量=32g+22g-40g=14g,故参加反应的B与生成的D的质量变化比为14g:22g=7:11。
11. 某实验过程如下:取 $ a\ {g} $锡粉置于密闭容器中,称得容器和固体的总质量为 $ b\ {g} $,煅烧使锡粉与氧气充分反应;冷却后打开容器时有空气进入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为 $ c\ {g} $;取出所有固体,称得固体质量为 $ d\ {g} $。则 $ c $等于(
A.$ d + b + a $
B.$ d - b - a $
C.$ d - b + a $
D.$ d + b - a $
D
)A.$ d + b + a $
B.$ d - b - a $
C.$ d - b + a $
D.$ d + b - a $
答案:
D 解析:容器质量为(b-a)g,所以c g=d g+(b-a)g,即c=d+b-a。
12. (2023·乐山)已知物质 $ {R} $由一种或多种物质组成。取一定质量的 $ {R} $在足量的氧气中完全燃烧,生成 $ 4.4\ {g} $二氧化碳和 $ 3.6\ {g} $水,下列分析不正确的是(
A.参加反应的 $ {R} $和氧气的总质量一定等于 $ 8.0\ {g} $
B.所取 $ {R} $的质量的最小值为 $ 1.6\ {g} $
C.$ {R} $可能是酒精 $ ({C_{2}H_{5}OH}) $
D.若 $ {R} $为 $ {CO} $和 $ {H_{2}} $的混合物,则 $ {CO} $和 $ {H_{2}} $的分子个数比为 $ 1:2 $
C
)A.参加反应的 $ {R} $和氧气的总质量一定等于 $ 8.0\ {g} $
B.所取 $ {R} $的质量的最小值为 $ 1.6\ {g} $
C.$ {R} $可能是酒精 $ ({C_{2}H_{5}OH}) $
D.若 $ {R} $为 $ {CO} $和 $ {H_{2}} $的混合物,则 $ {CO} $和 $ {H_{2}} $的分子个数比为 $ 1:2 $
答案:
C 解析:根据质量守恒定律可知,参加反应的物质的总质量等于反应后生成的物质的总质量,反应后生成的二氧化碳和水的总质量为4.4g+3.6g=8.0g,故参加反应的R和氧气的总质量也为8.0g,A的分析正确;反应后生成的二氧化碳中碳元素的质量为4.4g×(12/44×100%)=1.2g,生成的水中氢元素的质量为3.6g×(2/18×100%)=0.4g,反应前后元素的种类和质量保持不变,则反应前R中的碳元素和氢元素的质量分别为1.2g和0.4g,由于反应前后必须满足元素守恒,故R至少由C、H两种元素组成,则所取R的质量的最小值为1.2g+0.4g=1.6g,B的分析正确;由上述分析可知,R中C、H元素的质量比为1.2g:0.4g=3:1,而酒精(C₂H₅OH)中C、H元素的质量比为(12×2):(1×6)=4:1,C的分析错误;R中C、H元素的原子个数比为(1.2g/12):(0.4g/1)=1:4,若R为CO和H₂的混合物,则CO和H₂的混合物中C、H元素的原子个数比也是1:4,即CO和H₂的分子个数比为1:4/2=1:2,D的分析正确。
13. 为验证质量守恒定律,小华设计如图所示装置进行实验。实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置置于天平上,观察到
(资料:铁与稀盐酸反应生成氢气和易溶于水的氯化亚铁)
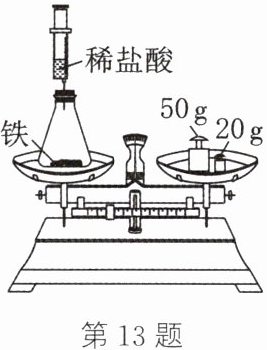
天平平衡(或指针指向分度盘的中央等合理答案均可)
,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是装置没有密闭,反应产生的气体逸出(合理答案均可)
。(资料:铁与稀盐酸反应生成氢气和易溶于水的氯化亚铁)

答案:
天平平衡(或指针指向分度盘的中央等合理答案均可) 装置没有密闭,反应产生的气体逸出(合理答案均可)
14. (2024·广元)乙醇 $ ({C_{2}H_{5}OH}) $是常用的燃料。现有 $ 4.6\ {g} $乙醇与一定量氧气混合于密闭容器内,在一定条件下反应物全部转化为一氧化碳、二氧化碳和水,恢复到室温,测得所得气体中氧元素质量分数为 $ 70\% $,则参加反应的氧气的质量为(
A.$ 6.4\ {g} $
B.$ 8.0\ {g} $
C.$ 8.8\ {g} $
D.$ 9.6\ {g} $
C
)A.$ 6.4\ {g} $
B.$ 8.0\ {g} $
C.$ 8.8\ {g} $
D.$ 9.6\ {g} $
答案:
C 解析:现有4.6g乙醇与一定量氧气混合于密闭容器内,在一定条件下反应物全部转化为一氧化碳、二氧化碳和水。4.6g乙醇(C₂H₅OH)中碳元素的质量为4.6g×(24/46×100%)=2.4g,氢元素的质量为4.6g×(6/46×100%)=0.6g。恢复到室温所得气体是一氧化碳和二氧化碳的混合物,其中氧元素质量分数为70%,则碳元素的质量分数为1-70%=30%,所以所得气体的质量为2.4g/30%=8g,乙醇燃烧生成水的质量为0.6g/(2/18×100%)=5.4g。根据质量守恒定律可知,参加反应的氧气的质量为8g+5.4g-4.6g=8.8g。
查看更多完整答案,请扫码查看


