第7页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
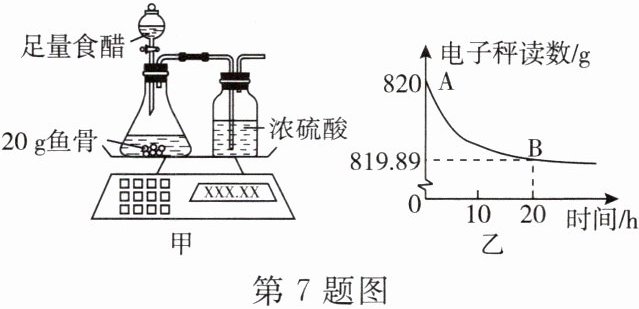
7. 鱼骨中的无机物主要是碳酸钙,碳酸钙能与醋酸发生化学反应,生成可溶性的物质。因此,有人认为通过用喝食醋的方法,能使鱼骨软化,使卡于咽部的鱼刺脱落。为判断这种做法是否可行,项目学习小组设计如图甲所示实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。
已知:①食醋的主要成分是醋酸($ {HAc} $),醋酸和碳酸钙反应的化学方程式为 $ {CaCO_{3}}+2{HAc}\xlongequal{}{Ca(Ac)_{2}}+{H_{2}O}+{CO_{2}}\uparrow $;
②鱼骨中其他成分与食醋反应生成的气体可忽略不计。
(1) 浓硫酸具有吸水性,该实验中浓硫酸的具体作用是______。
(2) 据图分析计算鱼骨中碳酸钙的质量分数。
(3) 项目学习小组认为,用喝食醋的方法除去卡在咽部的鱼刺的做法是不科学的。请结合图乙及实验结果加以说明:______。
已知:①食醋的主要成分是醋酸($ {HAc} $),醋酸和碳酸钙反应的化学方程式为 $ {CaCO_{3}}+2{HAc}\xlongequal{}{Ca(Ac)_{2}}+{H_{2}O}+{CO_{2}}\uparrow $;
②鱼骨中其他成分与食醋反应生成的气体可忽略不计。
(1) 浓硫酸具有吸水性,该实验中浓硫酸的具体作用是______。
(2) 据图分析计算鱼骨中碳酸钙的质量分数。
(3) 项目学习小组认为,用喝食醋的方法除去卡在咽部的鱼刺的做法是不科学的。请结合图乙及实验结果加以说明:______。

答案:
7.
(1)吸收二氧化碳中的水蒸气,减少实验的误差
(2)产生$CO_2$的质量为$820g - 819.89g = 0.11g$。设鱼骨中$CaCO_3$质量为$x$,$CaCO_3 + 2HAc = Ca(Ac)_2 + H_2O + CO_2↑$$100$ $44$$x$ $0.11g$$\frac{100}{x}=\frac{44}{0.11g}$解得$x = 0.25g$。则鱼骨中$CaCO_3$的质量分数=$\frac{0.25g}{20g}=1.25\%$。
(3)反应需要时间较长,而食醋只是瞬间流过,所以食醋效果不好(或鱼骨中碳酸钙含量少,合理即可)
(1)吸收二氧化碳中的水蒸气,减少实验的误差
(2)产生$CO_2$的质量为$820g - 819.89g = 0.11g$。设鱼骨中$CaCO_3$质量为$x$,$CaCO_3 + 2HAc = Ca(Ac)_2 + H_2O + CO_2↑$$100$ $44$$x$ $0.11g$$\frac{100}{x}=\frac{44}{0.11g}$解得$x = 0.25g$。则鱼骨中$CaCO_3$的质量分数=$\frac{0.25g}{20g}=1.25\%$。
(3)反应需要时间较长,而食醋只是瞬间流过,所以食醋效果不好(或鱼骨中碳酸钙含量少,合理即可)
8. 往 $ {FeCl_{3}} $ 和 $ {CuCl_{2}} $ 的混合溶液中加入铁粉。已知反应的先后顺序、化学方程式分别为:$ 2{FeCl_{3}}+{Fe}\xlongequal{}3{FeCl_{2}} $,$ {CuCl_{2}}+{Fe}\xlongequal{}{FeCl_{2}}+{Cu} $,如图所示为反应后混合液质量与加入铁粉质量的关系曲线,$ N $、$ M $、$ P $、$ Q $ 是曲线上的点,则下列说法错误的是(
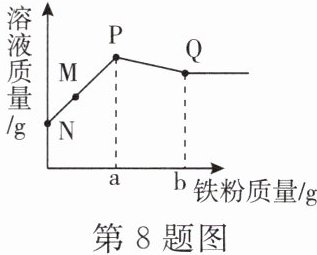
A.$ N\toP $ 发生的反应为化合反应
B.与 $ M $、$ P $、$ Q $ 对应的溶液中的溶质种类分别是 $ 3 $、$ 2 $、$ 1 $ 种
C.若 $ b = 2a $,则反应过程中溶液质量的增加量与减小量之比为 $ 8:7 $
D.若 $ b = 2a $,则原混合液中 $ {FeCl_{3}} $ 和 $ {CuCl_{2}} $ 的质量分数之比为 $ 65:27 $
C
)
A.$ N\toP $ 发生的反应为化合反应
B.与 $ M $、$ P $、$ Q $ 对应的溶液中的溶质种类分别是 $ 3 $、$ 2 $、$ 1 $ 种
C.若 $ b = 2a $,则反应过程中溶液质量的增加量与减小量之比为 $ 8:7 $
D.若 $ b = 2a $,则原混合液中 $ {FeCl_{3}} $ 和 $ {CuCl_{2}} $ 的质量分数之比为 $ 65:27 $
答案:
8.C
9. 将 $ 12.9 \, g $ 混有氯化钠的碳酸钠固体样品完全溶于水中形成 $ 90 \, g $ 溶液,再将 $ 75 \, g $ 氯化钙溶液分 $ 5 $ 次加入到该溶液中,充分反应,测得实验数据如表所示。该反应的化学方程式为 $ {Na_{2}CO_{3}}+{CaCl_{2}}\xlongequal{}{CaCO_{3}}\downarrow+2{NaCl} $。请分析并回答下列问题:
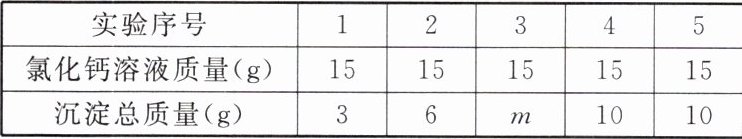
(1) 表格中 $ m $ 的值为。
(2) 氯化钙溶液的溶质质量分数为。
(3) 请计算固体混合物中碳酸钠的质量分数(计算结果精确到 $ 0.1\% $)。
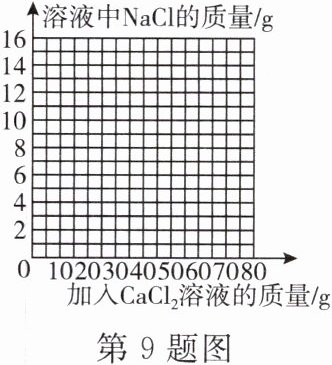
(4) 在图中画出溶液中氯化钠质量随加入氯化钙溶液的质量变化曲线。

(1) 表格中 $ m $ 的值为。
(2) 氯化钙溶液的溶质质量分数为。
(3) 请计算固体混合物中碳酸钠的质量分数(计算结果精确到 $ 0.1\% $)。
(4) 在图中画出溶液中氯化钠质量随加入氯化钙溶液的质量变化曲线。

答案:
9.
(1)$9$
(2)$22.2\%$
(3)设样品中碳酸钠的质量为$x$,反应生成氯化钠的质量为$y$。
$Na_2CO_3 + CaCl_2 = CaCO_3↓ + 2NaCl$ $106$ $100$ $117$ $x$ $10g$ $y$ $\frac{106}{x}=\frac{100}{10g}=\frac{117}{y}$ 解得$x = 10.6g$,$y = 11.7g$, 样品中$Na_2CO_3$质量分数:$\frac{10.6g}{12.9g}×100\%\approx82.2\%$。
(4)如答图所示。
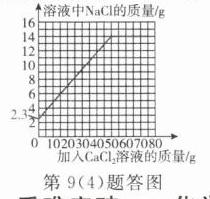
(注:原氯化钠质量$2.3g$,反应后氯化钠总质量$14g$,反应所用氯化钙溶液质量$50g$)
9.
(1)$9$
(2)$22.2\%$
(3)设样品中碳酸钠的质量为$x$,反应生成氯化钠的质量为$y$。
$Na_2CO_3 + CaCl_2 = CaCO_3↓ + 2NaCl$ $106$ $100$ $117$ $x$ $10g$ $y$ $\frac{106}{x}=\frac{100}{10g}=\frac{117}{y}$ 解得$x = 10.6g$,$y = 11.7g$, 样品中$Na_2CO_3$质量分数:$\frac{10.6g}{12.9g}×100\%\approx82.2\%$。
(4)如答图所示。

(注:原氯化钠质量$2.3g$,反应后氯化钠总质量$14g$,反应所用氯化钙溶液质量$50g$)
查看更多完整答案,请扫码查看


