第23页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
13. 有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,按以下流程进行实验:
(1)根据实验现象,白色粉末中一定没有____________________(填物质名称)。
(2)实验中不能用${BaCl_{2}}$溶液代替${Ba(NO_{3})_{2}}$溶液的理由是_。
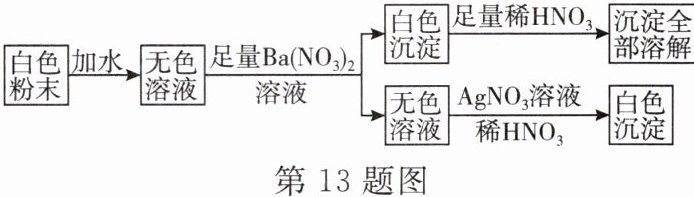
(1)根据实验现象,白色粉末中一定没有____________________(填物质名称)。
(2)实验中不能用${BaCl_{2}}$溶液代替${Ba(NO_{3})_{2}}$溶液的理由是_。

答案:
13.
(1)硫酸铜、硫酸钠
(2)引入了Cl⁻,对氯化钠的鉴别产生干扰
(1)硫酸铜、硫酸钠
(2)引入了Cl⁻,对氯化钠的鉴别产生干扰
14. 有一包白色固体样品,可能含氢氧化钠、硝酸钠、碳酸钠、硫酸钠、氯化钡中的一种或几种。小宁为探究其成分完成了下列实验:
①取少量白色固体溶于水,得到无色溶液,等分为两份;
②往一份无色溶液中加入稀硫酸,产生沉淀质量与所加稀硫酸质量关系如图所示;
③往另一份无色溶液中通入适量的${CO_{2}}$,产生白色沉淀。
请回答下列问题:
(1)仅根据①②推测原样品中一定不存在的物质是
(2)原样品的所有可能组成是_。
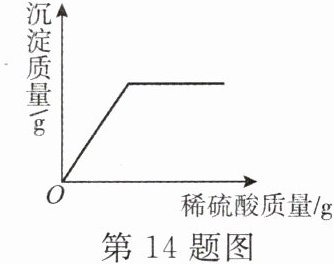
①取少量白色固体溶于水,得到无色溶液,等分为两份;
②往一份无色溶液中加入稀硫酸,产生沉淀质量与所加稀硫酸质量关系如图所示;
③往另一份无色溶液中通入适量的${CO_{2}}$,产生白色沉淀。
请回答下列问题:
(1)仅根据①②推测原样品中一定不存在的物质是
Na₂CO₃ 和 Na₂SO₄
(填化学式,下同)。(2)原样品的所有可能组成是_。

答案:
14.
(1)Na₂CO₃ 和 Na₂SO₄
(2)BaCl₂、NaOH;BaCl₂、NaOH、NaNO₃
(1)Na₂CO₃ 和 Na₂SO₄
(2)BaCl₂、NaOH;BaCl₂、NaOH、NaNO₃
15. “灰水粽”是指用草木灰的浸出液(俗称“灰水”)浸泡糯米做成的粽子,这种粽子颜色微黄、清香软糯。已知草木灰中富含钾盐,主要成分是${K_{2}CO_{3}}$,还有少量${KCl}$。为了检验草木灰的成分,并测试草木灰中${K_{2}CO_{3}}$的质量分数,小佳用图示装置进行实验。
(1)取适量草木灰于烧杯中,加足量水浸泡,过滤得到草木灰的浸出液;取少量浸出液于试管中,滴加几滴无色酚酞试液,观察到无色酚酞试液变红,则说明草木灰的浸出液呈
(2)写出检验草木灰的浸出液中存在${Cl^{-}}$的实验方法:_。
(3)实验过程中需持续缓缓通入空气,其作用是_。
(4)该实验通过测定
(5)取$50\ g$草木灰样品进行实验,实验前后装置$D$增重$4.4\ g$,求该样品中碳酸钾的质量分数(杂质不发生化学反应)。
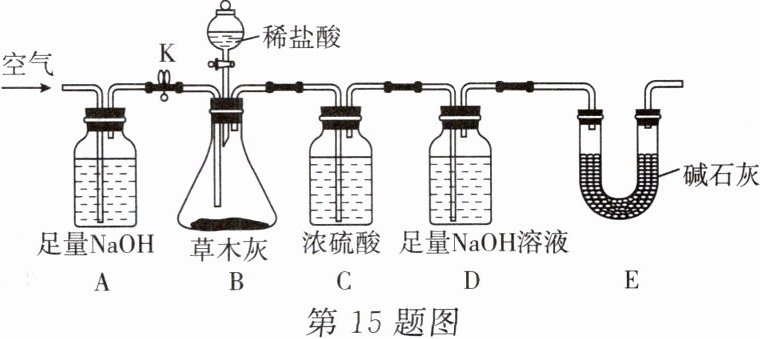
(1)取适量草木灰于烧杯中,加足量水浸泡,过滤得到草木灰的浸出液;取少量浸出液于试管中,滴加几滴无色酚酞试液,观察到无色酚酞试液变红,则说明草木灰的浸出液呈
碱性
。(2)写出检验草木灰的浸出液中存在${Cl^{-}}$的实验方法:_。
(3)实验过程中需持续缓缓通入空气,其作用是_。
(4)该实验通过测定
产生CO₂的质量
来粗略地计算${K_{2}CO_{3}}$的质量。(5)取$50\ g$草木灰样品进行实验,实验前后装置$D$增重$4.4\ g$,求该样品中碳酸钾的质量分数(杂质不发生化学反应)。

答案:
15.
(1)碱性
(2)向足量的草木灰浸出液中加入足量的硝酸钡和稀硝酸,过滤后取滤液加入硝酸银,若有白色沉淀,证明有氯离子
(3)使装置内的CO₂被D装置中的NaOH溶液充分吸收
(4)产生CO₂的质量
(5)设该样品中碳酸钾的质量分数为x。
K₂CO₃ + 2HCl = 2KCl + H₂O + CO₂↑
138 44
50 g×x 4.4 g
138/50 g×x = 44/4.4 g,解得x = 27.6%。
则该样品中碳酸钾的质量分数为27.6%。
(1)碱性
(2)向足量的草木灰浸出液中加入足量的硝酸钡和稀硝酸,过滤后取滤液加入硝酸银,若有白色沉淀,证明有氯离子
(3)使装置内的CO₂被D装置中的NaOH溶液充分吸收
(4)产生CO₂的质量
(5)设该样品中碳酸钾的质量分数为x。
K₂CO₃ + 2HCl = 2KCl + H₂O + CO₂↑
138 44
50 g×x 4.4 g
138/50 g×x = 44/4.4 g,解得x = 27.6%。
则该样品中碳酸钾的质量分数为27.6%。
16. 下列各组物质的溶液,不另加试剂就能鉴别出来的一组是(
A.${Na_{2}CO_{3}}$、${HCl}$、${H_{2}SO_{4}}$
B.${KCl}$、${NaCl}$、${Na_{2}SO_{4}}$
C.${FeCl_{3}}$、${NaOH}$、${KNO_{3}}$
D.${HCl}$、${NaOH}$、${Ca(OH)_{2}}$
C
)A.${Na_{2}CO_{3}}$、${HCl}$、${H_{2}SO_{4}}$
B.${KCl}$、${NaCl}$、${Na_{2}SO_{4}}$
C.${FeCl_{3}}$、${NaOH}$、${KNO_{3}}$
D.${HCl}$、${NaOH}$、${Ca(OH)_{2}}$
答案:
16.C
17. 在除杂质的操作中,为了将杂质完全去除,通常需加入过量的除杂试剂。为了除去${NaCl}$样品中混有的少量${Na_{2}SO_{4}}$和${MgCl_{2}}$,某校科学课外活动小组设计的提纯流程如图所示。
(1)加入过量的氢氧化钠可除去的阳离子是
(2)试剂$X$的化学式为
(3)某同学用提纯得到的${NaCl}$晶体配制一定溶质质量分数的氯化钠溶液,在量取液体时仰视读数,会导致所配制溶液的溶质质量分数偏
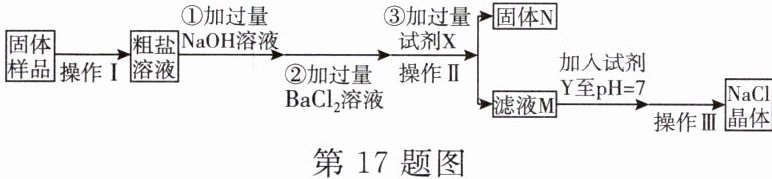
(1)加入过量的氢氧化钠可除去的阳离子是
Mg²⁺
(写离子符号)。(2)试剂$X$的化学式为
Na₂CO₃
,滤液$M$中所含有的阴离子有CO₃²⁻、Cl⁻、OH⁻
。(3)某同学用提纯得到的${NaCl}$晶体配制一定溶质质量分数的氯化钠溶液,在量取液体时仰视读数,会导致所配制溶液的溶质质量分数偏
小
(选填“大”或“小”)。
答案:
17.
(1)Mg²⁺
(2)Na₂CO₃ CO₃²⁻、Cl⁻、OH⁻
(3)小
(1)Mg²⁺
(2)Na₂CO₃ CO₃²⁻、Cl⁻、OH⁻
(3)小
查看更多完整答案,请扫码查看


