第11页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
典例4 实验室提供$H_{2}O_{2}$溶液、二氧化锰、$KClO_{3}$和$KMnO_{4}$四种药品及下列装置。

根据要求回答下列问题:
(1)根据提供的药品,写出一种实验室制取$O_{2}$的化学方程式:
(2)选择装置B和C制取氧气的主要步骤有:①将导气管移出水槽;②加热;③装药品;④收集;⑤熄灭酒精灯;⑥检查装置气密性。正确的操作顺序为

根据要求回答下列问题:
(1)根据提供的药品,写出一种实验室制取$O_{2}$的化学方程式:
2H₂O₂ \stackrel{MnO₂}{=\!=\!=} 2H₂O + O₂↑(或 2KClO₃ \stackrel{MnO₂}{\underset{\triangle}{=\!=\!=}} K₂MnO₄ + MnO₂ + O₂↑)
。(2)选择装置B和C制取氧气的主要步骤有:①将导气管移出水槽;②加热;③装药品;④收集;⑤熄灭酒精灯;⑥检查装置气密性。正确的操作顺序为
⑥③②④①⑤
(填序号)。
答案:
$(1)2H₂O₂ \stackrel{MnO₂}{=\!=\!=} 2H₂O + O₂↑($或$ 2KClO₃ \stackrel{MnO₂}{\underset{\triangle}{=\!=\!=}} K₂MnO₄ + MnO₂ + O₂↑)$
(2)⑥③②④①⑤
(2)⑥③②④①⑤
变式4 氧气可通过多种途径制取,如图甲、乙所示是制取氧气的两套装置。
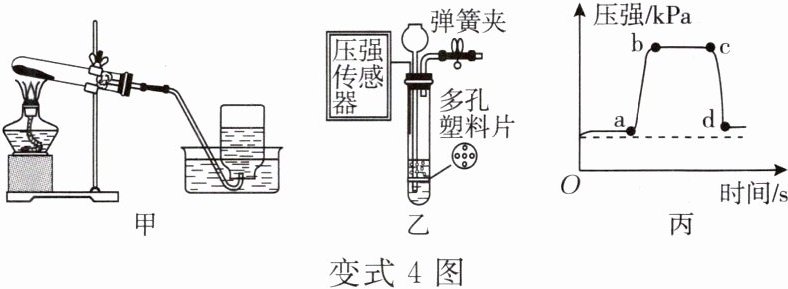
(1)若用装置甲制取氧气,当观察到导管口有
(2)小涛用胶水固化二氧化锰粉末,将制成的颗粒状二氧化锰置于多孔塑料片上方,利用装置乙进行实验。实验过程中某段时间试管内气压的变化如图丙所示,a点对应的操作是关闭弹簧夹。下列说法正确的有
A. ab段表示试管中液面逐渐上升
B. bc段表示二氧化锰与双氧水脱离接触
C. c点对应的操作是打开弹簧夹
(3)根据化学试剂的市场价格,实验室制取32g氧气的常用药品的成本如表所示。

结合表中信息,你认为在实验中选用双氧水制取氧气的优点是

(1)若用装置甲制取氧气,当观察到导管口有
有连续、均匀的气泡冒出
,即可开始收集气体。(2)小涛用胶水固化二氧化锰粉末,将制成的颗粒状二氧化锰置于多孔塑料片上方,利用装置乙进行实验。实验过程中某段时间试管内气压的变化如图丙所示,a点对应的操作是关闭弹簧夹。下列说法正确的有
BC
(填字母)。A. ab段表示试管中液面逐渐上升
B. bc段表示二氧化锰与双氧水脱离接触
C. c点对应的操作是打开弹簧夹
(3)根据化学试剂的市场价格,实验室制取32g氧气的常用药品的成本如表所示。

结合表中信息,你认为在实验中选用双氧水制取氧气的优点是
制取氧气的成本低且不需要消耗能源(或经济节能,合理即可)
。
答案:
(1)有连续、均匀的气泡冒出
(2)BC
(3)制取氧气的成本低且不需要消耗能源(或经济节能,合理即可)
(1)有连续、均匀的气泡冒出
(2)BC
(3)制取氧气的成本低且不需要消耗能源(或经济节能,合理即可)
典例5 小科学完酸的性质后,通过实验粗略测定现榨柠檬汁中柠檬酸的含量,先称取50g碳酸氢钠溶液于烧杯中,并将50g柠檬汁平均分成五次加入烧杯中,实验数据如表所示:(柠檬酸与小苏打反应的化学方程式为$C_{6}H_{8}O_{7}+3NaHCO_{3}=C_{6}H_{5}Na_{3}O_{7}+3H_{2}O+3CO_{2}\uparrow$)
(1)表中第⑤次实验的m值为
(2)柠檬汁中柠檬酸的质量分数为多少?
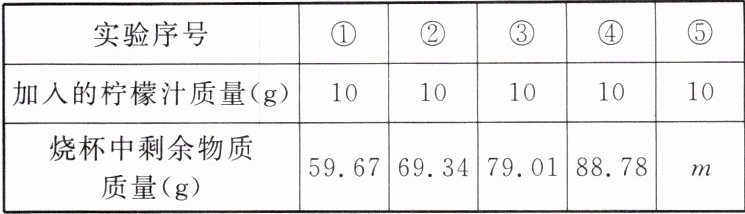
(1)表中第⑤次实验的m值为
98.78
。(2)柠檬汁中柠檬酸的质量分数为多少?

答案:
(1)98.78
(2)设10 g柠檬汁中柠檬酸的质量为x,第①次实验生成二氧化碳的质量为m = 50 g + 10 g - 59.67 g = 0.33 g。
C₆H₈O₇ + 3NaHCO₃ =\!=\!= C₆H₅Na₃O₇ + 3H₂O + 3CO₂↑
192 132
x 0.33 g
$\frac{192}{x} = \frac{132}{0.33 g}$
解得x = 0.48 g,
则柠檬汁中柠檬酸的质量分数为$\frac{0.48 g}{10 g} × 100% = 4.8%。$
(1)98.78
(2)设10 g柠檬汁中柠檬酸的质量为x,第①次实验生成二氧化碳的质量为m = 50 g + 10 g - 59.67 g = 0.33 g。
C₆H₈O₇ + 3NaHCO₃ =\!=\!= C₆H₅Na₃O₇ + 3H₂O + 3CO₂↑
192 132
x 0.33 g
$\frac{192}{x} = \frac{132}{0.33 g}$
解得x = 0.48 g,
则柠檬汁中柠檬酸的质量分数为$\frac{0.48 g}{10 g} × 100% = 4.8%。$
变式5 第19届亚运会在中国浙江杭州举办。这场盛会兑现了“绿色亚运”的承诺,其中蕴含着很多科学知识。
材料1:亚运会开幕式首次使用废碳再生的绿色零碳甲醇$(CH_{3}OH)$作为主火炬塔燃料,实现循环内$CO_{2}$的零排放。
材料2:吉祥物中的“莲莲”创意取自“接天莲叶无穷碧”,生产全程采用绿电,还优化了毛绒玩具中的填充原料、省去外包装环节,一只玩具可减少0.11kg二氧化碳的排放量。
材料3:亚运会使用氢氧燃料电池为动力的汽车,利用铁酸锌$(ZnFe_{2}O_{4})$循环制氢气和氧气的化学方程式为$6ZnFe_{2}O_{4}\xlongequal{1200^{\circ}C}6ZnO+4Fe_{3}O_{4}+O_{2}\uparrow$;$3ZnO+2Fe_{3}O_{4}+H_{2}O\xlongequal{700^{\circ}C}3ZnFe_{2}O_{4}+H_{2}\uparrow$。
回答下列问题:
(1)每生产1t绿色甲醇可以消纳多少吨的$CO_{2}$来实现循环内$CO_{2}$的零排放?
(2)若生产“莲莲”排放的二氧化碳原本需要氢氧化钠进行吸收,化学方程式为$2NaOH+CO_{2}=Na_{2}CO_{3}+H_{2}O$,如果生产10万只“莲莲”,减排后可以节约多少千克的氢氧化钠?
(3)通过利用铁酸锌$(ZnFe_{2}O_{4})$循环制氢气和氧气,计算得到$H_{2}$和$O_{2}$的质量比是多少?
材料1:亚运会开幕式首次使用废碳再生的绿色零碳甲醇$(CH_{3}OH)$作为主火炬塔燃料,实现循环内$CO_{2}$的零排放。
材料2:吉祥物中的“莲莲”创意取自“接天莲叶无穷碧”,生产全程采用绿电,还优化了毛绒玩具中的填充原料、省去外包装环节,一只玩具可减少0.11kg二氧化碳的排放量。
材料3:亚运会使用氢氧燃料电池为动力的汽车,利用铁酸锌$(ZnFe_{2}O_{4})$循环制氢气和氧气的化学方程式为$6ZnFe_{2}O_{4}\xlongequal{1200^{\circ}C}6ZnO+4Fe_{3}O_{4}+O_{2}\uparrow$;$3ZnO+2Fe_{3}O_{4}+H_{2}O\xlongequal{700^{\circ}C}3ZnFe_{2}O_{4}+H_{2}\uparrow$。
回答下列问题:
(1)每生产1t绿色甲醇可以消纳多少吨的$CO_{2}$来实现循环内$CO_{2}$的零排放?
(2)若生产“莲莲”排放的二氧化碳原本需要氢氧化钠进行吸收,化学方程式为$2NaOH+CO_{2}=Na_{2}CO_{3}+H_{2}O$,如果生产10万只“莲莲”,减排后可以节约多少千克的氢氧化钠?
(3)通过利用铁酸锌$(ZnFe_{2}O_{4})$循环制氢气和氧气,计算得到$H_{2}$和$O_{2}$的质量比是多少?
答案:
(1)设每生产1 t绿色甲醇可以消纳CO₂的质量为x。
由化学方程式列式可得:
CH₃OH ~ CO₂
32 44
1 t x
$\frac{44}{32} = \frac{x}{1 t}$
解得x = 1.375 t。
即每生产1 t绿色甲醇可以消纳1.375 t的CO₂。
(2)设可以节约的氢氧化钠的质量为y。
2NaOH + CO₂ =\!=\!= Na₂CO₃ + H₂O
80 44
y 1.1×10⁴ kg
$\frac{80}{y} = \frac{44}{1.1×10⁴ kg}$
解得y = 2×10⁴ kg。
即可以节约2×10⁴ kg的氢氧化钠。
(3)由题意可得反应中各物质间的比例关系为6ZnFe₂O₄ ~ O₂ ~ 2H₂,可得到H₂和O₂的质量比为4∶32 = 1∶8。
(1)设每生产1 t绿色甲醇可以消纳CO₂的质量为x。
由化学方程式列式可得:
CH₃OH ~ CO₂
32 44
1 t x
$\frac{44}{32} = \frac{x}{1 t}$
解得x = 1.375 t。
即每生产1 t绿色甲醇可以消纳1.375 t的CO₂。
(2)设可以节约的氢氧化钠的质量为y。
2NaOH + CO₂ =\!=\!= Na₂CO₃ + H₂O
80 44
y 1.1×10⁴ kg
$\frac{80}{y} = \frac{44}{1.1×10⁴ kg}$
解得y = 2×10⁴ kg。
即可以节约2×10⁴ kg的氢氧化钠。
(3)由题意可得反应中各物质间的比例关系为6ZnFe₂O₄ ~ O₂ ~ 2H₂,可得到H₂和O₂的质量比为4∶32 = 1∶8。
查看更多完整答案,请扫码查看


