第21页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
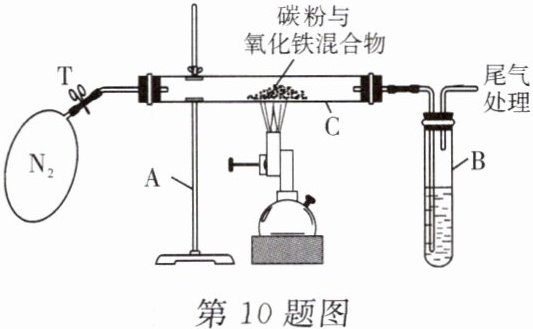
10. [科学探究]某科学兴趣小组的学生研究过量的碳粉与 $Fe_{2}O_{3}$ 在高温条件下反应的气体产物成分。探究过程如下:
Ⅰ. 提出假设:气体产物全部是 $CO_{2}$;气体产物是 $CO_{2}$ 和 CO 的混合物;气体产物全部是 CO。
Ⅱ. 查阅资料:a. 氮气不能与碳粉及 $Fe_{2}O_{3}$ 反应;b. 高温下可以发生下列反应:$2Fe_{2}O_{3}+3C\xlongequal{高温}4Fe+3CO_{2}\uparrow$、$C+CO_{2}\xlongequal{高温}2CO$。
Ⅲ. 设计方案:将一定量氧化铁在隔绝空气的环境下与过量碳粉充分反应。用实验中实际测得产生气体的质量,与理论计算得到的气体的质量进行比较。
Ⅳ. 实验装置:如图所示。
Ⅴ. 实验操作:
①称量:反应前 $Fe_{2}O_{3}$ 的质量 3.20 g;碳粉的质量 2.00 g;玻璃管 C 的质量 48.48 g。反应后玻璃管 C 与残留固体共 52.24 g。
②加热前先通一段时间氮气,再夹紧弹簧夹 T,点燃酒精喷灯加热。
Ⅵ. 问题分析:
(1) 加热前先通一段时间氮气的目的是________。
(2) 根据题意试管 B 中应加入的溶液是________。
(3) 根据题中所给数据,通过计算得出结论。
若气体产物全部是 $CO_{2}$,理论上应该得到气体质量是________;若气体产物全部是 CO,则气体质量是________。根据实验数据计算得到气体质量是________。可得结论:________(要求简述结论并说明理由)。
Ⅰ. 提出假设:气体产物全部是 $CO_{2}$;气体产物是 $CO_{2}$ 和 CO 的混合物;气体产物全部是 CO。
Ⅱ. 查阅资料:a. 氮气不能与碳粉及 $Fe_{2}O_{3}$ 反应;b. 高温下可以发生下列反应:$2Fe_{2}O_{3}+3C\xlongequal{高温}4Fe+3CO_{2}\uparrow$、$C+CO_{2}\xlongequal{高温}2CO$。
Ⅲ. 设计方案:将一定量氧化铁在隔绝空气的环境下与过量碳粉充分反应。用实验中实际测得产生气体的质量,与理论计算得到的气体的质量进行比较。
Ⅳ. 实验装置:如图所示。
Ⅴ. 实验操作:
①称量:反应前 $Fe_{2}O_{3}$ 的质量 3.20 g;碳粉的质量 2.00 g;玻璃管 C 的质量 48.48 g。反应后玻璃管 C 与残留固体共 52.24 g。
②加热前先通一段时间氮气,再夹紧弹簧夹 T,点燃酒精喷灯加热。
Ⅵ. 问题分析:
(1) 加热前先通一段时间氮气的目的是________。
(2) 根据题意试管 B 中应加入的溶液是________。
(3) 根据题中所给数据,通过计算得出结论。
若气体产物全部是 $CO_{2}$,理论上应该得到气体质量是________;若气体产物全部是 CO,则气体质量是________。根据实验数据计算得到气体质量是________。可得结论:________(要求简述结论并说明理由)。

答案:
10.
(1)清除试管中空气(氧气),防止碳粉与空气中氧气发生反应产生$\mathrm{CO_2}$干扰实验
(2)氢氧化钠溶液(或足量的氢氧化钙溶液,合理即可)
(3)1.32g 1.68g 1.44g 因为生成的气体质量在1.32g到1.68g之间,故气体产物不完全为$\mathrm{CO_2}$或$\mathrm{CO}$,实际是$\mathrm{CO_2}$和$\mathrm{CO}$的混合物
(1)清除试管中空气(氧气),防止碳粉与空气中氧气发生反应产生$\mathrm{CO_2}$干扰实验
(2)氢氧化钠溶液(或足量的氢氧化钙溶液,合理即可)
(3)1.32g 1.68g 1.44g 因为生成的气体质量在1.32g到1.68g之间,故气体产物不完全为$\mathrm{CO_2}$或$\mathrm{CO}$,实际是$\mathrm{CO_2}$和$\mathrm{CO}$的混合物
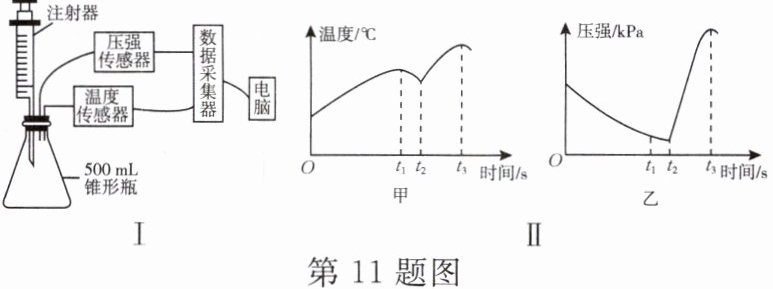
11. 某项目化学习小组用传感器开展“影响铁锈蚀因素”的探究,设计如图Ⅰ所示实验装置并完成实验。实验过程中,传感器采集数据绘制得到如图Ⅱ的甲、乙所示两幅曲线图。
资料 1:一定条件下,碳和氯化钠溶液可加快铁的锈蚀,但它们本身不参加反应。
资料 2:该实验步骤如下:
①检查装置气密性;
②装药品,将 5 g 铁粉和 2 g 碳粉加入锥形瓶,并加入 2 mL 饱和氯化钠溶液;
③立即塞紧橡皮塞,橡皮塞上已插有一支装有 5 mL 稀盐酸的注射器及传感器;
④观察现象,采集数据。
用所学知识及上述资料信息回答下列问题:
(1) 实验进行一段时间后,注射器中的盐酸会自动注入瓶内,原因是________。
(2) 图Ⅱ甲、乙曲线图中,$O~t_{1}$ 段温度升高,瓶内压强减小;$t_{2}~t_{3}$ 段温度升高,瓶内压强增大。解释产生这两个不同现象的原因。
资料 1:一定条件下,碳和氯化钠溶液可加快铁的锈蚀,但它们本身不参加反应。
资料 2:该实验步骤如下:
①检查装置气密性;
②装药品,将 5 g 铁粉和 2 g 碳粉加入锥形瓶,并加入 2 mL 饱和氯化钠溶液;
③立即塞紧橡皮塞,橡皮塞上已插有一支装有 5 mL 稀盐酸的注射器及传感器;
④观察现象,采集数据。
用所学知识及上述资料信息回答下列问题:
(1) 实验进行一段时间后,注射器中的盐酸会自动注入瓶内,原因是________。
(2) 图Ⅱ甲、乙曲线图中,$O~t_{1}$ 段温度升高,瓶内压强减小;$t_{2}~t_{3}$ 段温度升高,瓶内压强增大。解释产生这两个不同现象的原因。

答案:
11.
(1)铁发生反应消耗氧气,当瓶内气压减小到一定程度,大气压将注射器的活塞下压(或瓶内气压减小,盐酸被吸入瓶内,合理即可)
(2)知识要点:
①铁生锈消耗氧气并放热;②盐酸与铁反应生成氢气并放出热量;③升高温度使瓶内压强增大;④增加或减少气体会使瓶内压强发生变化。
答题要点:
$\mathrm{O\sim t_1}$段:①铁生锈消耗氧气并放热;②反应放热使温度升高,压强增大;③消耗氧气使压强减小;④消耗氧气减小的压强大于温度升高增大的压强。所以$\mathrm{O\sim t_1}$段总体上温度升高,压强减小。
$\mathrm{t_2\sim t_3}$段:①因瓶内气压减小,盐酸被大气压压入瓶内,盐酸与铁反应产生氢气并放出大量的热;②温度升高,压强增大;③产生氢气,压强增大;④温度升高和产生氢气都使压强增大。所以$\mathrm{t_2\sim t_3}$段总体上温度升高,压强增大。
第
(2)小题的不同水平答案示例如下:
等级 回答
高水平回答 能综合多个要素辩证地进行解释,原理正确,逻辑科学,要素齐全。
示例:
铁生锈消耗氧气的同时放出热量,反应放出的热量使温度升高,压强增大,消耗氧气会使瓶内压强减小。但由于消耗氧气减小的压强大于温度升高增大的压强,所以$\mathrm{O\sim t_1}$段温度升高,压强减小。
因瓶内压强减小,盐酸被压入瓶内,盐酸与铁反应产生氢气并放出热量,反应放出的热量使温度升高,压强增大,反应产生的氢气也会使瓶内压强增大,所以$\mathrm{t_2\sim t_3}$段温度升高,压强增大。
中上水平回答 能从部分要素进行解释、原理部分正确,逻辑比较清晰,缺少部分要素。
示例:
铁生锈消耗氧气的同时放出热量,反应放出的热量使温度升高,压强增大,消耗氧气会使瓶内压强减小。
盐酸与铁反应产生氢气放出热量,反应放出的热量使温度升高,压强增大,反应产生的氢气会使瓶内压强增大。
中下水平回答 只能对其中某1~2个要素作出单一解释。
示例1:
铁生锈消耗氧气的同时放出热量,反应放出的热量使温度升高,压强增大。
示例2:
铁生锈消耗氧气会使瓶内压强减小,盐酸与铁反应产生氢气,压强增大。
低水平回答 不能运用相关科学原理作出解释或同义反复或不作答。
示例:铁生锈使瓶内气压增大;或盐酸与铁锈反应使气压增大等。
(1)铁发生反应消耗氧气,当瓶内气压减小到一定程度,大气压将注射器的活塞下压(或瓶内气压减小,盐酸被吸入瓶内,合理即可)
(2)知识要点:
①铁生锈消耗氧气并放热;②盐酸与铁反应生成氢气并放出热量;③升高温度使瓶内压强增大;④增加或减少气体会使瓶内压强发生变化。
答题要点:
$\mathrm{O\sim t_1}$段:①铁生锈消耗氧气并放热;②反应放热使温度升高,压强增大;③消耗氧气使压强减小;④消耗氧气减小的压强大于温度升高增大的压强。所以$\mathrm{O\sim t_1}$段总体上温度升高,压强减小。
$\mathrm{t_2\sim t_3}$段:①因瓶内气压减小,盐酸被大气压压入瓶内,盐酸与铁反应产生氢气并放出大量的热;②温度升高,压强增大;③产生氢气,压强增大;④温度升高和产生氢气都使压强增大。所以$\mathrm{t_2\sim t_3}$段总体上温度升高,压强增大。
第
(2)小题的不同水平答案示例如下:
等级 回答
高水平回答 能综合多个要素辩证地进行解释,原理正确,逻辑科学,要素齐全。
示例:
铁生锈消耗氧气的同时放出热量,反应放出的热量使温度升高,压强增大,消耗氧气会使瓶内压强减小。但由于消耗氧气减小的压强大于温度升高增大的压强,所以$\mathrm{O\sim t_1}$段温度升高,压强减小。
因瓶内压强减小,盐酸被压入瓶内,盐酸与铁反应产生氢气并放出热量,反应放出的热量使温度升高,压强增大,反应产生的氢气也会使瓶内压强增大,所以$\mathrm{t_2\sim t_3}$段温度升高,压强增大。
中上水平回答 能从部分要素进行解释、原理部分正确,逻辑比较清晰,缺少部分要素。
示例:
铁生锈消耗氧气的同时放出热量,反应放出的热量使温度升高,压强增大,消耗氧气会使瓶内压强减小。
盐酸与铁反应产生氢气放出热量,反应放出的热量使温度升高,压强增大,反应产生的氢气会使瓶内压强增大。
中下水平回答 只能对其中某1~2个要素作出单一解释。
示例1:
铁生锈消耗氧气的同时放出热量,反应放出的热量使温度升高,压强增大。
示例2:
铁生锈消耗氧气会使瓶内压强减小,盐酸与铁反应产生氢气,压强增大。
低水平回答 不能运用相关科学原理作出解释或同义反复或不作答。
示例:铁生锈使瓶内气压增大;或盐酸与铁锈反应使气压增大等。
查看更多完整答案,请扫码查看


