第25页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
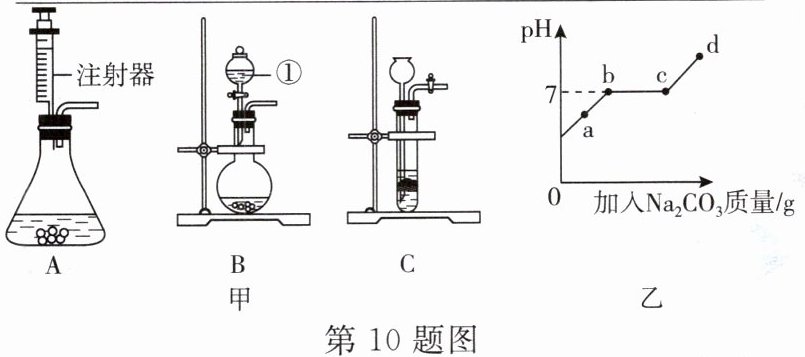
10. (1)实验室用石灰石和稀盐酸制取 $ {CO_{2}} $ 的原理是
(2)在反应装置的残液中加入 $ {Na_{2}CO_{3}} $ 溶液,溶液 $ pH $ 变化如图乙所示(提示:氯化钙溶液呈中性):a 点时,溶液中的溶质的化学式是________________________;bc 段溶液 $ pH $ 一直为 7 的理由是________________________。滴入 $ {Na_{2}CO_{3}} $ 溶液的过程中观察到的现象依次是________________________。
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
(写化学方程式),可选用如图甲所示的装置ABC
(填字母)制 $ {CO_{2}} $。使用装置 B 时仪器①的作用是通过控制加入液体的流速来控制反应的速度
。(2)在反应装置的残液中加入 $ {Na_{2}CO_{3}} $ 溶液,溶液 $ pH $ 变化如图乙所示(提示:氯化钙溶液呈中性):a 点时,溶液中的溶质的化学式是________________________;bc 段溶液 $ pH $ 一直为 7 的理由是________________________。滴入 $ {Na_{2}CO_{3}} $ 溶液的过程中观察到的现象依次是________________________。

答案:
10.
(1)CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑ ABC 通过控制加入液体的流速来控制反应的速度
(2)CaCl₂、HCl、NaCl 在bc段发生的是CaCl₂与Na₂CO₃的反应,CaCl₂呈中性,与滴入的Na₂CO₃反应生成的NaCl溶液也呈中性,所以在bc段pH值为7 先有气泡产生再有白色沉淀产生
(1)CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑ ABC 通过控制加入液体的流速来控制反应的速度
(2)CaCl₂、HCl、NaCl 在bc段发生的是CaCl₂与Na₂CO₃的反应,CaCl₂呈中性,与滴入的Na₂CO₃反应生成的NaCl溶液也呈中性,所以在bc段pH值为7 先有气泡产生再有白色沉淀产生
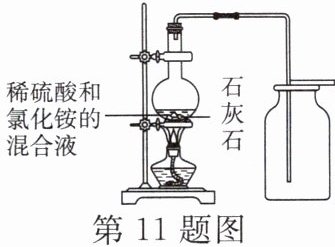
11. 实验室常用盐酸和石灰石反应制取二氧化碳。
【发现问题】实验中要检验生成的气体是二氧化碳,将反应后的气体通入石灰水中,有时会有在开始一段时间内未发现石灰水变浑浊的现象。
(1)对产生该现象的原因进行探究后发现,用盐酸和碳酸钙制取二氧化碳时,生成的二氧化碳中会含有氯化氢气体,将气体通入石灰水时,氯化氢溶于水形成盐酸,会将二氧化碳和石灰水反应生成的碳酸钙沉淀溶解,写出该反应的化学方程式:
【实验改进】用不会挥发的稀硫酸替换稀盐酸。
(2)但实验室通常不选用稀硫酸和石灰石反应制取二氧化碳,原因是________________________,会阻碍反应的进一步进行。
(3)某小组经研究,用如图所示方法成功制得了大量 $ {CO_{2}} $(反应物为稀硫酸和石灰石)。(注:硫酸钙能溶于铵盐溶液)
①如图所示稀硫酸和石灰石反应的实验中,在稀硫酸溶液中加入氯化铵和对溶液加热的两个操作,其目的都是________________________。
②改进实验是为了得到更好的实验效果。如果将产生的气体通入
【发现问题】实验中要检验生成的气体是二氧化碳,将反应后的气体通入石灰水中,有时会有在开始一段时间内未发现石灰水变浑浊的现象。
(1)对产生该现象的原因进行探究后发现,用盐酸和碳酸钙制取二氧化碳时,生成的二氧化碳中会含有氯化氢气体,将气体通入石灰水时,氯化氢溶于水形成盐酸,会将二氧化碳和石灰水反应生成的碳酸钙沉淀溶解,写出该反应的化学方程式:
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
。【实验改进】用不会挥发的稀硫酸替换稀盐酸。
(2)但实验室通常不选用稀硫酸和石灰石反应制取二氧化碳,原因是________________________,会阻碍反应的进一步进行。
(3)某小组经研究,用如图所示方法成功制得了大量 $ {CO_{2}} $(反应物为稀硫酸和石灰石)。(注:硫酸钙能溶于铵盐溶液)
①如图所示稀硫酸和石灰石反应的实验中,在稀硫酸溶液中加入氯化铵和对溶液加热的两个操作,其目的都是________________________。
②改进实验是为了得到更好的实验效果。如果将产生的气体通入
加有稀硝酸的硝酸银溶液
,无白色沉淀生成,可证明此方案符合改进的出发点。
答案:
11.
(1)CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
(2)稀硫酸和石灰石反应生成的硫酸钙微溶于水,覆盖在石灰石表面
(3)①增大硫酸钙在溶液中的溶解能力 ②加有稀硝酸的硝酸银溶液
(1)CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
(2)稀硫酸和石灰石反应生成的硫酸钙微溶于水,覆盖在石灰石表面
(3)①增大硫酸钙在溶液中的溶解能力 ②加有稀硝酸的硝酸银溶液
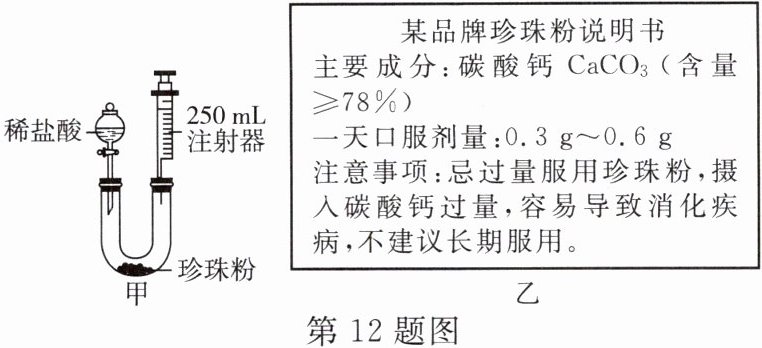
12. 珍珠粉的主要成分是碳酸钙,其作为一种新型补钙剂,越来越受人们的青睐。兴趣小组利用图甲装置测定人工养殖珍珠中碳酸钙的含量。实验步骤如下:
①检查装置气密性。
②注射器活塞推到底部,向装置内装入 $ 1.25 \, g $ 磨成粉的珍珠样品,分液漏斗内加入足量稀盐酸,再次连接装置。
③打开分液漏斗活塞,将 $ 20 \, mL $ 足量稀盐酸加入装置后立即关闭活塞,充分反应后,观察到气泡不再产生,记录此时注射器的示数为 $ 240 \, mL $。
资料:标准状况下,二氧化碳气体的密度约为 $ 2.0 \, g/L $;珍珠粉中其他成分不与稀盐酸反应,反应的化学方程式为 $ {CaCO_{3} + 2HCl \xlongequal{} CaCl_{2} + H_{2}O + CO_{2} \uparrow} $;甲装置固定装置已省略,不考虑活塞的摩擦和自重。
(1)检查装置气密性:关闭分液漏斗活塞,将注射器活塞从 $ 0 \, mL $ 处向上拉至 $ 100 \, mL $,如果气密性良好,松手后能观察到的现象是
(2)求该人工养殖珍珠中碳酸钙的质量分数。
(3)结合图乙药房售卖的某品牌珍珠粉说明书,你认为上述人工养殖珍珠磨成粉是否可内服,你的理由是什么?
①检查装置气密性。
②注射器活塞推到底部,向装置内装入 $ 1.25 \, g $ 磨成粉的珍珠样品,分液漏斗内加入足量稀盐酸,再次连接装置。
③打开分液漏斗活塞,将 $ 20 \, mL $ 足量稀盐酸加入装置后立即关闭活塞,充分反应后,观察到气泡不再产生,记录此时注射器的示数为 $ 240 \, mL $。
资料:标准状况下,二氧化碳气体的密度约为 $ 2.0 \, g/L $;珍珠粉中其他成分不与稀盐酸反应,反应的化学方程式为 $ {CaCO_{3} + 2HCl \xlongequal{} CaCl_{2} + H_{2}O + CO_{2} \uparrow} $;甲装置固定装置已省略,不考虑活塞的摩擦和自重。
(1)检查装置气密性:关闭分液漏斗活塞,将注射器活塞从 $ 0 \, mL $ 处向上拉至 $ 100 \, mL $,如果气密性良好,松手后能观察到的现象是
活塞重新回到0mL刻度处
。(2)求该人工养殖珍珠中碳酸钙的质量分数。
(3)结合图乙药房售卖的某品牌珍珠粉说明书,你认为上述人工养殖珍珠磨成粉是否可内服,你的理由是什么?

答案:
12.
(1)活塞重新回到0mL刻度处
(2)充分反应后,注射器的示数为240mL,则产生二氧化碳气体的体积是240mL - 20mL = 220mL = 0.22L,则产生二氧化碳气体的质量是0.22L×2.0g/L = 0.44g,设1.25g磨成粉的珍珠样品中碳酸钙的质量为x。
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
100 44
x 0.44g
$\frac{100}{x} = \frac{44}{0.44g},$解得x = 1g。
则该人工养殖珍珠中碳酸钙的质量分数为$\frac{1g}{1.25g}×100% = 80%。$
(3)可内服,但一天服用的剂量不能超过0.6g,摄入碳酸钙过量,会导致消化系统疾病(或不可内服,现磨的珍珠粉没有经过处理,可能含有对人体有害的物质等,合理即可)
(1)活塞重新回到0mL刻度处
(2)充分反应后,注射器的示数为240mL,则产生二氧化碳气体的体积是240mL - 20mL = 220mL = 0.22L,则产生二氧化碳气体的质量是0.22L×2.0g/L = 0.44g,设1.25g磨成粉的珍珠样品中碳酸钙的质量为x。
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
100 44
x 0.44g
$\frac{100}{x} = \frac{44}{0.44g},$解得x = 1g。
则该人工养殖珍珠中碳酸钙的质量分数为$\frac{1g}{1.25g}×100% = 80%。$
(3)可内服,但一天服用的剂量不能超过0.6g,摄入碳酸钙过量,会导致消化系统疾病(或不可内服,现磨的珍珠粉没有经过处理,可能含有对人体有害的物质等,合理即可)
查看更多完整答案,请扫码查看


