2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
10. 有五瓶失去标签的溶液,它们分别为$①Ba(NO_3)_2、$②KCl、③NaOH、$④CuSO_4、$$⑤Na_2SO_4,$如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则在下列的鉴别顺序中,最合理的是 (
A.④③①⑤②
B.④③⑤②①
C.①⑤③④②
D.③④①⑤②
A
)A.④③①⑤②
B.④③⑤②①
C.①⑤③④②
D.③④①⑤②
答案:
A [首先根据溶液颜色鉴别出蓝色 $ CuSO_{4} $ 溶液,用蓝色 $ CuSO_{4} $ 溶液可鉴别出 NaOH 溶液(生成蓝色沉淀)和 $ Ba(NO_{3})_{2} $ 溶液(生成白色沉淀),再用 $ Ba(NO_{3})_{2} $ 溶液做试剂可鉴别出 $ Na_{2}SO_{4} $ 溶液(生成白色沉淀),最后剩下的为 KCl 溶液。]
11. 下列反应的离子方程式正确的是 (
A.用$Ca(ClO)_2$溶液吸收$SO_2$制石膏乳:$ClO⁻ + SO_2 + 2OH⁻ = Cl⁻ + SO_4^2⁻ + H_2O$
B.向$H_2^1^8O$中投入$Na_2O_2$固体:$2H_2^1^8O + 2Na_2O_2 = 4Na⁺ + 4OH⁻ + ^1^8O_2↑$
C.向$CuSO_4$溶液通入$H_2S$:$Cu^2⁺ + S^2⁻ = CuS↓$
D.利用MnO_2和浓盐酸反应制备Cl_2:MnO_2 + 4H⁺ + 2Cl⁻ $\xlongequal{\triangle}$ Mn^2⁺ + Cl_2↑ + 2H_2O
D
)A.用$Ca(ClO)_2$溶液吸收$SO_2$制石膏乳:$ClO⁻ + SO_2 + 2OH⁻ = Cl⁻ + SO_4^2⁻ + H_2O$
B.向$H_2^1^8O$中投入$Na_2O_2$固体:$2H_2^1^8O + 2Na_2O_2 = 4Na⁺ + 4OH⁻ + ^1^8O_2↑$
C.向$CuSO_4$溶液通入$H_2S$:$Cu^2⁺ + S^2⁻ = CuS↓$
D.利用MnO_2和浓盐酸反应制备Cl_2:MnO_2 + 4H⁺ + 2Cl⁻ $\xlongequal{\triangle}$ Mn^2⁺ + Cl_2↑ + 2H_2O
答案:
D [A. 用 $ Ca(ClO)_{2} $ 溶液吸收 $ SO_{2} $ 生成的硫酸钙微溶,不能拆为离子形式,故 A 错误;B. 过氧化钠与水反应生成氢氧化钠和氧气,氧气中的氧来源于过氧化钠中 -1 价的 O,过氧化钠中 -1 价的 O 的化合价有一半升高,另一半降低,过氧化钠既是氧化剂又是还原剂,因此该反应的离子方程式为 $ 2H_{2}^{18}O + 2Na_{2}O_{2} = 4Na^{+} + 2^{18}OH^{-} + 2OH^{-} + O_{2} \uparrow + 2H_{2}O $,故 B 错误;C. $ H_{2}S $ 溶于水形成氢硫酸为弱酸,不能写为离子形式,该反应的离子方程式为 $ Cu^{2+} + H_{2}S = CuS \downarrow + 2H^{+} $,故 C 错误;D. $ MnO_{2} $ 和浓盐酸在加热条件下反应生成氯化锰、氯气和水,该反应的离子方程式为 $ MnO_{2} + 4H^{+} + 2Cl^{-} \xlongequal{\triangle} Mn^{2+} + Cl_{2} \uparrow + 2H_{2}O $,故 D 正确。]
12. 某无色溶液中只可能大量含有K⁺、Ag⁺、$Ba^2⁺、$$Fe^3⁺、$Cl⁻、OH⁻、$CO_3^2⁻、$$SO_4^2⁻$中的若干种,对其进行如下实验操作:
(1)取少量该溶液,测得能使紫色石蕊试液变蓝色;
(2)另取少量该溶液,加入少量$BaCl_2$溶液,产生白色沉淀;
(3)向(2)所得体系中加入足量盐酸,沉淀部分溶解,并有无色气体生成,过滤;
(4)向(3)所得滤液中加入$AgNO_3$溶液,有白色沉淀生成。
下列对该溶液的说法正确的是(已知AgOH难溶于水且易分解为$Ag_2O$固体) (
A.一定含有K⁺、OH⁻、$CO_3^2⁻、$$SO_4^2⁻$
B.可能含有Cl⁻、OH⁻
C.一定不含有Ag⁺、$Ba^2⁺、$$Fe^3⁺、$Cl⁻
D.无法判断该溶液中离子的存在情况
(1)取少量该溶液,测得能使紫色石蕊试液变蓝色;
(2)另取少量该溶液,加入少量$BaCl_2$溶液,产生白色沉淀;
(3)向(2)所得体系中加入足量盐酸,沉淀部分溶解,并有无色气体生成,过滤;
(4)向(3)所得滤液中加入$AgNO_3$溶液,有白色沉淀生成。
下列对该溶液的说法正确的是(已知AgOH难溶于水且易分解为$Ag_2O$固体) (
A
)A.一定含有K⁺、OH⁻、$CO_3^2⁻、$$SO_4^2⁻$
B.可能含有Cl⁻、OH⁻
C.一定不含有Ag⁺、$Ba^2⁺、$$Fe^3⁺、$Cl⁻
D.无法判断该溶液中离子的存在情况
答案:
A [该溶液无色,其中一定不含 $ Fe^{3+} $(棕黄色);取少量该溶液,测得能使紫色石蕊试液变蓝色,则溶液呈碱性,则该溶液中一定含有 $ OH^{-} $,一定不含有 $ Ag^{+} $;另取少量该溶液,加入少量 $ BaCl_{2} $ 溶液,产生白色沉淀,则该溶液中至少含有 $ CO_{3}^{2-} $、$ SO_{4}^{2-} $ 中的一种;向
(2) 所得体系中加入足量盐酸,沉淀部分溶解,并无无色气体生成,证明
(2) 所得体系中含有碳酸钡和硫酸钡两种沉淀,碳酸钡溶于盐酸生成无色气体 $ CO_{2} $,硫酸钡不溶于盐酸,则该溶液中一定含有 $ CO_{3}^{2-} $、$ SO_{4}^{2-} $,一定不含 $ Ba^{2+} $;向
(3) 所得滤液中加入 $ AgNO_{3} $ 溶液,有白色沉淀生成,因
(2) 和
(3) 中均引入了 $ Cl^{-} $,故不能确定该溶液中是否含 $ Cl^{-} $;根据溶液呈电中性可知,该溶液中一定含有 $ K^{+} $。综上可知,该溶液中一定含有 $ K^{+} $、$ OH^{-} $、$ CO_{3}^{2-} $、$ SO_{4}^{2-} $,一定不含 $ Ba^{2+} $、$ Fe^{3+} $、$ Ag^{+} $,可能含有 $ Cl^{-} $,故 A 项正确。]
(2) 所得体系中加入足量盐酸,沉淀部分溶解,并无无色气体生成,证明
(2) 所得体系中含有碳酸钡和硫酸钡两种沉淀,碳酸钡溶于盐酸生成无色气体 $ CO_{2} $,硫酸钡不溶于盐酸,则该溶液中一定含有 $ CO_{3}^{2-} $、$ SO_{4}^{2-} $,一定不含 $ Ba^{2+} $;向
(3) 所得滤液中加入 $ AgNO_{3} $ 溶液,有白色沉淀生成,因
(2) 和
(3) 中均引入了 $ Cl^{-} $,故不能确定该溶液中是否含 $ Cl^{-} $;根据溶液呈电中性可知,该溶液中一定含有 $ K^{+} $。综上可知,该溶液中一定含有 $ K^{+} $、$ OH^{-} $、$ CO_{3}^{2-} $、$ SO_{4}^{2-} $,一定不含 $ Ba^{2+} $、$ Fe^{3+} $、$ Ag^{+} $,可能含有 $ Cl^{-} $,故 A 项正确。]
13. 某学习小组为证实$Ba(OH)_2$溶液和$H_2SO_4$溶液的反应是离子反应,设计了如下实验。请把该实验报告补充完整。
(1)[实验原理] 溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察
[实验装置] 如图1所示。
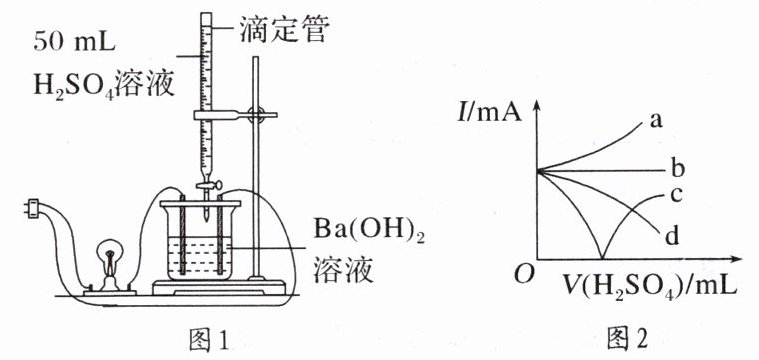
[实验过程与记录]
|实验步骤|实验现象|实验结论|
|连接好装置,向烧杯中加入25mL一定浓度的$Ba(OH)_2$溶液和2滴酚酞溶液,逐滴滴加一定浓度的$H_2SO_4$溶液直至过量,边滴边振荡|
(2)整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图2中的曲线
(3)书写下列两种情况的离子方程式。
①向$NaHSO_4$溶液中,逐滴加入$Ba(OH)_2$溶液至$SO_4^2⁻$恰好完全沉淀:
②向$NaHSO_4$溶液中,逐滴加入$Ba(OH)_2$溶液至溶液显中性:
(4)已知:$PbSO_4$难溶于水,但可溶于醋酸氨溶液中形成无色溶液,生成的$(CH_3COO)_2Pb$是难电离的物质,其化学方程式为$PbSO_4 + 2CH_3COONH_4 = (CH_3COO)_2Pb + (NH_4)_2SO_4。$写出该反应的离子方程式:
(1)[实验原理] 溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察
灯泡的明暗程度
,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。[实验装置] 如图1所示。

[实验过程与记录]
|实验步骤|实验现象|实验结论|
|连接好装置,向烧杯中加入25mL一定浓度的$Ba(OH)_2$溶液和2滴酚酞溶液,逐滴滴加一定浓度的$H_2SO_4$溶液直至过量,边滴边振荡|
灯泡由明变暗,直至熄灭,然后又逐渐变亮
(填写支持实验结论的证据)|$ Ba(OH)_2$溶液和$H_2SO_4$溶液的反应是离子反应|(2)整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图2中的曲线
c
(填字母)表示。(3)书写下列两种情况的离子方程式。
①向$NaHSO_4$溶液中,逐滴加入$Ba(OH)_2$溶液至$SO_4^2⁻$恰好完全沉淀:
$ OH^{-} + H^{+} + Ba^{2+} + SO_{4}^{2-} = H_{2}O + BaSO_{4} \downarrow $
。②向$NaHSO_4$溶液中,逐滴加入$Ba(OH)_2$溶液至溶液显中性:
$ 2OH^{-} + 2H^{+} + Ba^{2+} + SO_{4}^{2-} = 2H_{2}O + BaSO_{4} \downarrow $
。(4)已知:$PbSO_4$难溶于水,但可溶于醋酸氨溶液中形成无色溶液,生成的$(CH_3COO)_2Pb$是难电离的物质,其化学方程式为$PbSO_4 + 2CH_3COONH_4 = (CH_3COO)_2Pb + (NH_4)_2SO_4。$写出该反应的离子方程式:
$ PbSO_{4} + 2CH_{3}COO^{-} = (CH_{3}COO)_{2}Pb + SO_{4}^{2-} $
。
答案:
13.
(1) 灯泡的明暗程度 灯泡由明变暗,直至熄灭,然后又逐渐变亮
(2) c
(3) ① $ OH^{-} + H^{+} + Ba^{2+} + SO_{4}^{2-} = H_{2}O + BaSO_{4} \downarrow $ ② $ 2OH^{-} + 2H^{+} + Ba^{2+} + SO_{4}^{2-} = 2H_{2}O + BaSO_{4} \downarrow $
(4) $ PbSO_{4} + 2CH_{3}COO^{-} = (CH_{3}COO)_{2}Pb + SO_{4}^{2-} $
(1) 灯泡的明暗程度 灯泡由明变暗,直至熄灭,然后又逐渐变亮
(2) c
(3) ① $ OH^{-} + H^{+} + Ba^{2+} + SO_{4}^{2-} = H_{2}O + BaSO_{4} \downarrow $ ② $ 2OH^{-} + 2H^{+} + Ba^{2+} + SO_{4}^{2-} = 2H_{2}O + BaSO_{4} \downarrow $
(4) $ PbSO_{4} + 2CH_{3}COO^{-} = (CH_{3}COO)_{2}Pb + SO_{4}^{2-} $
查看更多完整答案,请扫码查看


