2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
9. (2024·安徽亳州高一期末)次氯酸消毒液高效安全,适用于一般物体表面消毒、手部消毒以及地面、空间和环境消毒。实验室利用如下装置制取氯气并制取次氯酸消毒液。
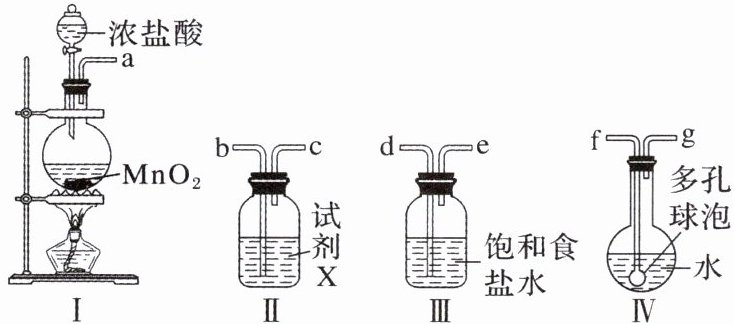
(1)装置合理的连接顺序为a→
(2)装置Ⅰ中反应的离子方程式是
(3)装置Ⅱ中试剂X是
(4)反应结束后,取装置Ⅳ中少量液体于试管中,滴入几滴石蕊溶液,观察到的现象是

(1)装置合理的连接顺序为a→
defgbc
(按气流方向填各接口的编号)。(2)装置Ⅰ中反应的离子方程式是
MnO₂+4H⁺+2Cl⁻$\xlongequal{\triangle}$Mn²⁺+Cl₂↑+2H₂O
。(3)装置Ⅱ中试剂X是
氢氧化钠溶液
;装置Ⅳ中多孔球泡的作用为增大氯气与水的接触面积使氯气与水充分反应
。(4)反应结束后,取装置Ⅳ中少量液体于试管中,滴入几滴石蕊溶液,观察到的现象是
溶液先变红后褪色
,请分析原因Cl₂+H₂O⇌H⁺+Cl⁻+HClO
(用离子方程式表示)。
答案:
(1)defgbc
(2)MnO₂+4H⁺+2Cl⁻$\xlongequal{\triangle}$Mn²⁺+Cl₂↑+2H₂O
(3)氢氧化钠溶液 增大氯气与水的接触面积使氯气与水充分反应
(4)溶液先变红后褪色 Cl₂+H₂O⇌H⁺+Cl⁻+HClO 解析
(1)按气流方向装置Ⅰ制备氯气,装置Ⅲ除去氯气中的氯化氢,装置Ⅳ氯气与水反应制备HClO消毒液,装置Ⅱ为尾气处理装置,气体通入液体导管长进短出,故正确答案为adefgbc。
(3)试剂X是NaOH溶液,吸收尾气中多余的氯气;装置Ⅳ中多孔球泡能增大氯气与水的接触面积,使氯气与水充分反应。
(1)defgbc
(2)MnO₂+4H⁺+2Cl⁻$\xlongequal{\triangle}$Mn²⁺+Cl₂↑+2H₂O
(3)氢氧化钠溶液 增大氯气与水的接触面积使氯气与水充分反应
(4)溶液先变红后褪色 Cl₂+H₂O⇌H⁺+Cl⁻+HClO 解析
(1)按气流方向装置Ⅰ制备氯气,装置Ⅲ除去氯气中的氯化氢,装置Ⅳ氯气与水反应制备HClO消毒液,装置Ⅱ为尾气处理装置,气体通入液体导管长进短出,故正确答案为adefgbc。
(3)试剂X是NaOH溶液,吸收尾气中多余的氯气;装置Ⅳ中多孔球泡能增大氯气与水的接触面积,使氯气与水充分反应。
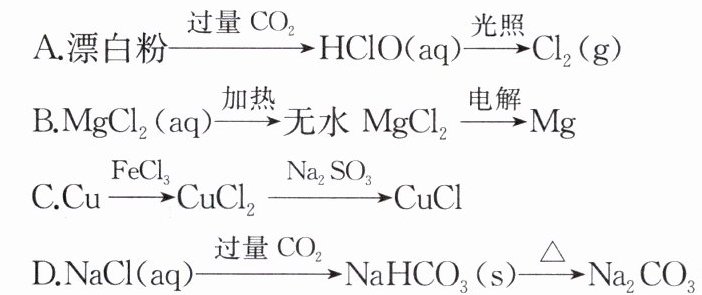
10. 氯及含氯物质在生产、生活中具有广泛的应用。下列含氯物质的转化正确的是(
C
)
答案:
C [HClO见光分解生成O₂,2HClO$\xlongequal{光照}$2HCl+O₂↑,A错误;加热MgCl₂溶液时,会促进Mg²⁺水解生成Mg(OH)₂,得不到无水MgCl₂,B错误;发生反应2FeCl₃+Cu=CuCl₂+2FeCl₂、2CuCl₂+Na₂SO₃+H₂O=2CuCl↓+Na₂SO₄+2HCl,C正确;先将NH₃通入饱和NaCl溶液中,再通入CO₂才可制得NaHCO₃晶体,D错误。]
11. 部分含氯物质的分类与相应化合价关系如图所示。下列推断不合理的是(
A.常温下,a、d水溶液的pH:a<d
B.b既具有氧化性,又具有还原性
C.c可用于自来水消毒
D.e或f分别与a的浓溶液反应均可制得b
A
)A.常温下,a、d水溶液的pH:a<d
B.b既具有氧化性,又具有还原性
C.c可用于自来水消毒
D.e或f分别与a的浓溶液反应均可制得b
答案:
A [由元素的化合价及物质类别可知,a为HCl,b为Cl₂,c为ClO₂,d为HClO,e为次氯酸盐,f为氯酸盐。未说明溶液浓度,无法比较溶液的pH,A错误;氯气中氯元素化合价为0价,处于中间价态,既具有氧化性,又具有还原性,B正确;ClO₂具有强氧化性,可用于自来水消毒,C正确;ClO₃⁻、ClO⁻分别与浓盐酸混合发生归中反应,均可制备氯气,D正确。]
12. 高铁酸钾$(K_2FeO_4)$是一种环保、高效、多功能饮用水处理剂,制备流程如图所示,下列叙述不正确的是(
A.用$K_2FeO_4$对饮用水杀菌消毒的同时,还产生$Fe(OH)_3$胶体吸附杂质净化水
B.用$FeCl_2$溶液吸收反应Ⅰ中尾气后可再利用
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为3:2
D.该生产条件下,物质的溶解性:$Na_2FeO_4<K_2FeO_4$
D
)A.用$K_2FeO_4$对饮用水杀菌消毒的同时,还产生$Fe(OH)_3$胶体吸附杂质净化水
B.用$FeCl_2$溶液吸收反应Ⅰ中尾气后可再利用
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为3:2
D.该生产条件下,物质的溶解性:$Na_2FeO_4<K_2FeO_4$
答案:
D [尾气含有氯气,与氯化亚铁反应生成氯化铁,可再利用,故B正确;反应中Cl元素化合价由+1价降低为-1价,Fe元素化合价由+3价升高到+6价,则氧化剂与还原剂的物质的量之比为3:2,故C正确;结晶过程中加入饱和KOH溶液,增大了K⁺浓度,该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,有利于K₂FeO₄晶体的析出,故D错误。]
13. 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)家庭中常用“84”消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下。

①消毒液与洁厕灵不能同时使用,原因是
②“84”消毒液的制取和漂白粉的制取原理相同,都是用氯气和碱反应来制取,“84”消毒液所用的碱是氢氧化钠溶液,写出该反应的离子方程式:
(2)NaClO可以用于除去废水中的铵态氮,配平下列离子方程式:
(3)工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若反应后的NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为
(4)$Cl_2$和$ClO_2$都是强氧化剂,能杀死水中的病菌。等质量的$ClO_2$的氧化能力是$Cl_2$的
(1)家庭中常用“84”消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下。

①消毒液与洁厕灵不能同时使用,原因是
ClO⁻+Cl⁻+2H⁺=Cl₂↑+H₂O
(用离子方程式表示)。②“84”消毒液的制取和漂白粉的制取原理相同,都是用氯气和碱反应来制取,“84”消毒液所用的碱是氢氧化钠溶液,写出该反应的离子方程式:
Cl₂+2OH⁻=Cl⁻+ClO⁻+H₂O
。(2)NaClO可以用于除去废水中的铵态氮,配平下列离子方程式:
2
$NH_4⁺$ + 3
ClO⁻$\xlongequal{}$1
$N_2$↑ + 3
Cl⁻ + 3
$H_2O $+ 2H⁺
。(3)工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若反应后的NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为
203
kg(保留整数)。(4)$Cl_2$和$ClO_2$都是强氧化剂,能杀死水中的病菌。等质量的$ClO_2$的氧化能力是$Cl_2$的
2.63
倍(保留小数点后2位)。
答案:
(1)①ClO⁻+Cl⁻+2H⁺=Cl₂↑+H₂O ②Cl₂+2OH⁻=Cl⁻+ClO⁻+H₂O
(2)2NH₄⁺+3ClO⁻=N₂↑+3Cl⁻+3H₂O+2H⁺
(3)203
(4)2.63 解析
(1)②氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl₂+2OH⁻=Cl⁻+ClO⁻+H₂O。
(2)反应NH₄⁺+ClO⁻→N₂+Cl⁻+H₂O+H⁺中,N元素的化合价升高3,Cl元素的化合价降低2,化合价升降数的最小公倍数为6,则NH₄⁺、ClO⁻的计量数分别为2、3,N₂、Cl⁻的计量数分别为1、3,结合电荷守恒可知,H⁺、H₂O的计量数分别为2、3,所以配平后的离子方程式为2NH₄⁺+3ClO⁻=N₂↑+3Cl⁻+3H₂O+2H⁺。
(3)已知发生的反应为Cl₂+2NaOH=NaClO+NaCl+H₂O,设消耗氯气的质量为x kg,则消耗NaOH的质量为$\frac{80}{71}$x kg,原NaOH的质量为($\frac{80}{71}$x+1000×1%)kg,由质量守恒可知,原NaOH溶液的质量为(1000-x)kg,则$\frac{80}{71}$x kg+1000 kg×1%=(1000 kg-x kg)×30%,解得x≈203。
(1)①ClO⁻+Cl⁻+2H⁺=Cl₂↑+H₂O ②Cl₂+2OH⁻=Cl⁻+ClO⁻+H₂O
(2)2NH₄⁺+3ClO⁻=N₂↑+3Cl⁻+3H₂O+2H⁺
(3)203
(4)2.63 解析
(1)②氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl₂+2OH⁻=Cl⁻+ClO⁻+H₂O。
(2)反应NH₄⁺+ClO⁻→N₂+Cl⁻+H₂O+H⁺中,N元素的化合价升高3,Cl元素的化合价降低2,化合价升降数的最小公倍数为6,则NH₄⁺、ClO⁻的计量数分别为2、3,N₂、Cl⁻的计量数分别为1、3,结合电荷守恒可知,H⁺、H₂O的计量数分别为2、3,所以配平后的离子方程式为2NH₄⁺+3ClO⁻=N₂↑+3Cl⁻+3H₂O+2H⁺。
(3)已知发生的反应为Cl₂+2NaOH=NaClO+NaCl+H₂O,设消耗氯气的质量为x kg,则消耗NaOH的质量为$\frac{80}{71}$x kg,原NaOH的质量为($\frac{80}{71}$x+1000×1%)kg,由质量守恒可知,原NaOH溶液的质量为(1000-x)kg,则$\frac{80}{71}$x kg+1000 kg×1%=(1000 kg-x kg)×30%,解得x≈203。
查看更多完整答案,请扫码查看


