2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
9. 已知A为常见的金属单质,存在如图所示的关系,下列叙述正确的是 (
A.A为Fe,B为FeO
B.C→D溶液的颜色变化:由浅绿色到棕黄色
C.④的离子方程式:$Fe + Fe^3⁺ = 2Fe^2⁺$
D.⑤的离子方程式:$4Fe(OH)_2 + O_2 + 2H_2O = 4Fe(OH)_3$
B
)A.A为Fe,B为FeO
B.C→D溶液的颜色变化:由浅绿色到棕黄色
C.④的离子方程式:$Fe + Fe^3⁺ = 2Fe^2⁺$
D.⑤的离子方程式:$4Fe(OH)_2 + O_2 + 2H_2O = 4Fe(OH)_3$
答案:
9. B [由红褐色固体可知,F是Fe(OH)₃,从而得出A为Fe,黑色晶体B为Fe₃O₄,继而推出C为FeCl₂,D为FeCl₃,E为Fe(OH)₂。④的离子方程式:Fe + 2Fe³⁺ = 3Fe²⁺,⑤的离子方程式:2Fe²⁺ + Cl₂ = 2Fe³⁺ + 2Cl⁻。]
10. 向含有$1 mol HNO_3$和$1 mol H_2SO_4$的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是 (
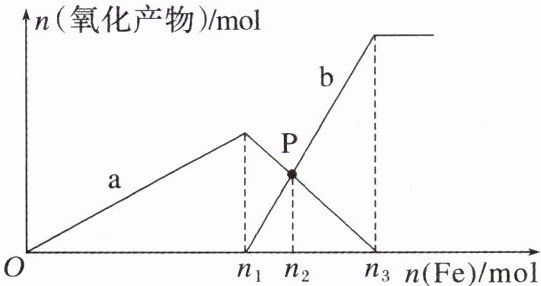
A.a表示$Fe^3⁺$的关系曲线
$B.n_1 = 0.75$
C.P点时$,n(Fe^2⁺) = 0.5625 mol$
D.向P点溶液中加入铜粉,最多可溶解14.4 g
C
)
A.a表示$Fe^3⁺$的关系曲线
$B.n_1 = 0.75$
C.P点时$,n(Fe^2⁺) = 0.5625 mol$
D.向P点溶液中加入铜粉,最多可溶解14.4 g
答案:
10. C [该反应可以看作两步:①Fe + 4H⁺ + NO₃⁻ = Fe³⁺ + NO↑ + 2H₂O,硝酸根离子过量,氢离子不足;②2Fe³⁺ + Fe = 3Fe²⁺。a表示Fe³⁺的关系曲线,A正确;溶液中共有3mol H⁺参加反应,消耗0.75mol铁,B正确;P点n(Fe²⁺) = n(Fe³⁺),两者均为0.45mol,C不正确;P点剩余0.45mol Fe³⁺,消耗0.225mol铜,质量为14.4g,D正确。]
11. 某兴趣小组同学为研究Cu与$Fe^3⁺$的反应进行如下实验(已知CuCl为白色固体,微溶于水):
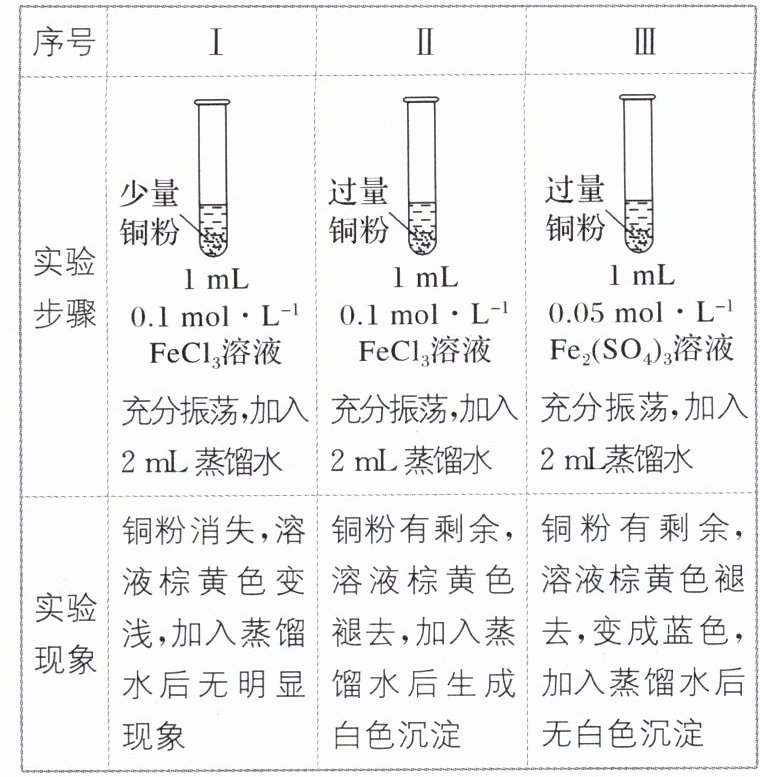
下列说法不正确的是 (
A.3个实验中消耗的铜粉的量不完全一样
B.实验Ⅰ、Ⅱ、Ⅲ中均发生了反应$2Fe^3⁺ + Cu = Cu^2⁺ + 2Fe^2⁺$
C.Ⅱ中加蒸馏水后的离子反应可能是$Cu^2⁺ + Cu + 2Cl⁻ = 2CuCl↓$
D.上述实验表明能否形成白色沉淀主要取决于加入Cu的量

下列说法不正确的是 (
D
)A.3个实验中消耗的铜粉的量不完全一样
B.实验Ⅰ、Ⅱ、Ⅲ中均发生了反应$2Fe^3⁺ + Cu = Cu^2⁺ + 2Fe^2⁺$
C.Ⅱ中加蒸馏水后的离子反应可能是$Cu^2⁺ + Cu + 2Cl⁻ = 2CuCl↓$
D.上述实验表明能否形成白色沉淀主要取决于加入Cu的量
答案:
11. D [实验Ⅱ中Cu部分转化为CuCl消耗的铜粉多于其他两个实验,A正确;实验Ⅰ、Ⅱ、Ⅲ中溶液棕黄色均褪去,推测都发生了反应:2Fe³⁺ + Cu = Cu²⁺ + 2Fe²⁺,B正确;Ⅱ中加蒸馏水后生成白色沉淀,根据元素种类推测应为CuCl,可能的离子反应为Cu²⁺ + Cu + 2Cl⁻ = 2CuCl↓,C正确;实验Ⅱ、Ⅲ均加入过量的铜,后者未产生白色沉淀,表明能否形成白色沉淀由Cu的量和Cl⁻的浓度共同决定,D不正确。]
12. 人们可以从不同角度研究含铁物质的性质及其转化关系。回答下列问题:
(1)Na₂FeO₄是一种新型饮用水消毒剂。工业上常用NaClO、Fe(NO₃)₃、NaOH制备:3ClO⁻ + 2Fe³⁺ + 10OH⁻ = 2FeO₄²⁻ + 3Cl⁻ + 5H₂O,设Nₐ代表阿伏加德罗常数的值,当反应转移电子的数目是0.3Nₐ时,所消耗氧化剂的物质的量为______
(2)打印机使用的墨粉中含有Fe₃O₄,下列关于Fe₃O₄的说法正确的是______
a. 有磁性,是FeO与Fe₂O₃的混合物
b. 属于两性氧化物,与酸、碱都能反应
c. FeO在空气里受热能迅速生成Fe₃O₄
d. Fe₃O₄能被CO还原为Fe粉
(3)维生素C易溶于水,可将Fe³⁺转化为Fe²⁺被人体吸收。为检验转化产物Fe²⁺,设计如下实验:取适量Fe₂(SO₄)₃溶液置于试管中,加入过量维生素C片振荡溶解后,滴加酸性高锰酸钾溶液,紫色褪去。该设计______
(1)Na₂FeO₄是一种新型饮用水消毒剂。工业上常用NaClO、Fe(NO₃)₃、NaOH制备:3ClO⁻ + 2Fe³⁺ + 10OH⁻ = 2FeO₄²⁻ + 3Cl⁻ + 5H₂O,设Nₐ代表阿伏加德罗常数的值,当反应转移电子的数目是0.3Nₐ时,所消耗氧化剂的物质的量为______
0.15mol
。(2)打印机使用的墨粉中含有Fe₃O₄,下列关于Fe₃O₄的说法正确的是______
cd
(填字母)。a. 有磁性,是FeO与Fe₂O₃的混合物
b. 属于两性氧化物,与酸、碱都能反应
c. FeO在空气里受热能迅速生成Fe₃O₄
d. Fe₃O₄能被CO还原为Fe粉
(3)维生素C易溶于水,可将Fe³⁺转化为Fe²⁺被人体吸收。为检验转化产物Fe²⁺,设计如下实验:取适量Fe₂(SO₄)₃溶液置于试管中,加入过量维生素C片振荡溶解后,滴加酸性高锰酸钾溶液,紫色褪去。该设计______
不能
(填“能”或“不能”)检验Fe²⁺的生成。部分变质的FeCl₂溶液可制得Fe₂O₃。若100 mL该溶液最终制得1.6 g Fe₂O₃,不考虑过程损失,变质前FeCl₂溶液的浓度为______0.2mol·L⁻¹
。
答案:
12.
(1)0.15mol
(2)cd
(3)不能 0.2mol·L⁻¹
解析
(1)3ClO⁻ + 2Fe³⁺ + 10OH⁻ = 2FeO₄²⁻ + 3Cl⁻ + 5H₂O反应中,氧化剂为ClO⁻,氯元素由+1价降低到-1价,3mol ClO⁻被完全还原,转移6mol电子,所以当反应转移电子的数目是0.3N_A时,所消耗氧化剂的物质的量为0.15mol。
(2)四氧化三铁有磁性,是纯净物,a错误;四氧化三铁只与酸反应,不与碱反应,不属于两性氧化物,b错误;FeO中铁元素为+2价,还原性较强,在空气里受热,发生氧化还原反应,能迅速生成Fe₃O₄,c正确;高温条件下Fe₃O₄能被CO还原为Fe粉,同时生成二氧化碳,d正确。
(3)维生素C易溶于水,可将Fe³⁺转化为Fe²⁺被人体吸收,说明维生素C具有还原性;亚铁离子、过量的维生素C均能被酸性高锰酸钾溶液氧化,导致其褪色,干扰了亚铁离子的检验,此实验方案设计不严密;1.6g Fe₂O₃的物质的量为 $\frac{1.6g}{160g·mol^{-1}} = 0.01mol$,铁元素的物质的量n(Fe) = 0.02mol;根据铁元素守恒,变质前n(FeCl₂) = n(Fe) = 0.02mol,则100mL该溶液中, $c(FeCl₂) = \frac{0.02mol}{0.1L} = 0.2mol·L^{-1}$。
(1)0.15mol
(2)cd
(3)不能 0.2mol·L⁻¹
解析
(1)3ClO⁻ + 2Fe³⁺ + 10OH⁻ = 2FeO₄²⁻ + 3Cl⁻ + 5H₂O反应中,氧化剂为ClO⁻,氯元素由+1价降低到-1价,3mol ClO⁻被完全还原,转移6mol电子,所以当反应转移电子的数目是0.3N_A时,所消耗氧化剂的物质的量为0.15mol。
(2)四氧化三铁有磁性,是纯净物,a错误;四氧化三铁只与酸反应,不与碱反应,不属于两性氧化物,b错误;FeO中铁元素为+2价,还原性较强,在空气里受热,发生氧化还原反应,能迅速生成Fe₃O₄,c正确;高温条件下Fe₃O₄能被CO还原为Fe粉,同时生成二氧化碳,d正确。
(3)维生素C易溶于水,可将Fe³⁺转化为Fe²⁺被人体吸收,说明维生素C具有还原性;亚铁离子、过量的维生素C均能被酸性高锰酸钾溶液氧化,导致其褪色,干扰了亚铁离子的检验,此实验方案设计不严密;1.6g Fe₂O₃的物质的量为 $\frac{1.6g}{160g·mol^{-1}} = 0.01mol$,铁元素的物质的量n(Fe) = 0.02mol;根据铁元素守恒,变质前n(FeCl₂) = n(Fe) = 0.02mol,则100mL该溶液中, $c(FeCl₂) = \frac{0.02mol}{0.1L} = 0.2mol·L^{-1}$。
查看更多完整答案,请扫码查看


