2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
2. (2024·四川成都期中)下列说法正确的是(
A.58.5 g NaCl中约含有$6.02×10^{23}$个NaCl分子
B.摩尔是一个物理量,表示含有一定数目粒子的集合体
C.1 mol任何粒子的质量数值上与该粒子的相对原子质量或相对分子质量相等
D.2 mol $NH_{3}$的摩尔质量为17 g·$mol^{-1}$
C
)A.58.5 g NaCl中约含有$6.02×10^{23}$个NaCl分子
B.摩尔是一个物理量,表示含有一定数目粒子的集合体
C.1 mol任何粒子的质量数值上与该粒子的相对原子质量或相对分子质量相等
D.2 mol $NH_{3}$的摩尔质量为17 g·$mol^{-1}$
答案:
2. C [A.氯化钠中不存在氯化钠分子,只存在钠离子和氯离子,故A错误;B.物质的量是七个基本物理量之一,摩尔是物质的量的单位,故B错误;C.1mol任何粒子的质量数值上与该粒子的相对原子质量或相对分子质量相等,故C正确;D.氨气的摩尔质量为17g·mol⁻¹,与物质的量无关,故D错误。]
3. (2024·西安高一月考)下列叙述正确的是(
A.标准状况下,22.4 L的任何气体的物质的量都是1 mol
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.标准状况下,1 mol $SO_{3}$所占的体积约为22.4 L
D.1 mol任何气体的体积都为22.4 L
A
)A.标准状况下,22.4 L的任何气体的物质的量都是1 mol
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.标准状况下,1 mol $SO_{3}$所占的体积约为22.4 L
D.1 mol任何气体的体积都为22.4 L
答案:
3. A [标准状况下,22.4L的任何气体的物质的量都是1mol,A正确;1mol任何物质在标准状况下所占的体积不一定为22.4L,如固体、液体,B错误;标准状况下SO₃不是气体,1molSO₃的体积不是22.4L,C错误;没有指明温度和压强,1mol任何气体的体积不一定为22.4L,D错误。]
4. $N_{A}$代表阿伏加德罗常数,下列说法正确的是(
A.60 g冰醋酸溶于水,所得溶液中$H^{+}个数为N_{A}$
B.0.1 mol Fe与0.1 mol $Cl_{2}$反应,转移电子数为$0.3N_{A}$
C.3.6 g CO和$N_{2}的混合气体含有质子数为1.8N_{A}$
D.实验室用足量$MnO_{2}$与含有0.4 mol HCl的浓盐酸制氯气,得到0.2 mol $Cl_{2}$
C
)A.60 g冰醋酸溶于水,所得溶液中$H^{+}个数为N_{A}$
B.0.1 mol Fe与0.1 mol $Cl_{2}$反应,转移电子数为$0.3N_{A}$
C.3.6 g CO和$N_{2}的混合气体含有质子数为1.8N_{A}$
D.实验室用足量$MnO_{2}$与含有0.4 mol HCl的浓盐酸制氯气,得到0.2 mol $Cl_{2}$
答案:
4. C [A.60g冰醋酸为1mol,它是弱电解质,不能完全电离,所以溶液中氢离子数目小于Nₐ,A错误;B.0.1mol铁和0.1mol氯气反应时,方程式为2Fe+3Cl₂$\xlongequal{\triangle}$2FeCl₃,铁过量,0.1mol氯气完全反应,转移0.2Nₐ个电子,B错误;C.CO和N₂的摩尔质量均为28g·mol⁻¹,3.6g混合气体的物质的量为$\frac{3.6g}{28g·mol⁻¹}$=$\frac{9}{70}$mol,每个分子含14个质子,质子数为$\frac{9}{70}$×14×Nₐ=1.8Nₐ,C正确;D.随着反应进行,盐酸浓度减小,MnO₂与稀盐酸不反应,生成氯气小于0.2mol,D错误。]
5. (2024·高三上福建龙岩期中)联合制碱法利用食盐水、氨气和二氧化碳制纯碱,涉及的反应之一为$NaCl+CO_{2}+NH_{3}+H_{2}O= NaHCO_{3}\downarrow +NH_{4}Cl$。设$N_{A}$为阿伏加德罗常数的值。下列说法正确的是(
A.常温常压下,22 g $CO_{2}含氧原子的数目为N_{A}$
B.0.1 mol·$L^{-1}$$NH_{4}Cl溶液中含Cl^{-}数目为0.1N_{A}$
C.0.1 mol $NaHCO_{3}晶体中含离子数目为0.3N_{A}$
D.标准状况下,11.2 L $NH_{3}$通入水中,溶液中$NH_{4}^{+}数目为0.5N_{A}$
A
)A.常温常压下,22 g $CO_{2}含氧原子的数目为N_{A}$
B.0.1 mol·$L^{-1}$$NH_{4}Cl溶液中含Cl^{-}数目为0.1N_{A}$
C.0.1 mol $NaHCO_{3}晶体中含离子数目为0.3N_{A}$
D.标准状况下,11.2 L $NH_{3}$通入水中,溶液中$NH_{4}^{+}数目为0.5N_{A}$
答案:
5. A [A.22gCO₂的物质的量为$\frac{22g}{44g·mol⁻¹}$=0.5mol,含氧原子数目为0.5×2×Nₐ=Nₐ,A正确;B.没有溶液体积,无法计算Cl⁻数目,B错误;C.NaHCO₃由Na⁺和HCO₃⁻构成,0.1molNaHCO₃含离子数目为0.2Nₐ,C错误;D.NH₃通入水中存在平衡:NH₃+H₂O⇌NH₃·H₂O⇌NH₄⁺+OH⁻,溶液中NH₄⁺、NH₃·H₂O、NH₃数目之和为0.5Nₐ,D错误。]
6. 相等物质的量的CO和$CO_{2}$相比较,下列有关叙述正确的是(
①它们所含的分子数目之比为1:1 ②它们所含的O原子数目之比为1:2 ③它们所含的原子总数目之比为2:3 ④它们所含的C原子数目之比为1:1 ⑤它们所含的电子数目之比为7:11
A.①②③④
B.②③
C.④⑤
D.①②③④⑤
D
)①它们所含的分子数目之比为1:1 ②它们所含的O原子数目之比为1:2 ③它们所含的原子总数目之比为2:3 ④它们所含的C原子数目之比为1:1 ⑤它们所含的电子数目之比为7:11
A.①②③④
B.②③
C.④⑤
D.①②③④⑤
答案:
6. D [CO、CO₂的物质的量相同,分子数目之比为1:1,①正确;O原子数目之比为1:2,②正确;原子总数目之比为2:3,③正确;C原子数目之比为1:1,④正确;电子数目之比为(6+8):(6+16)=14:22=7:11,⑤正确,故①②③④⑤均正确,D正确。]
7. (2024·高一上福建三明期中)下列叙述正确的是(
A.1 L水中溶解40 g NaOH固体后,所得溶液的物质的量浓度为1 mol·$L^{-1}$
B.配制1 L 0.2 mol·$L^{-1}的CuSO_{4}$溶液,需用32.0 g胆矾
C.将标准状况下2.24 L HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol·$L^{-1}$
D.用密度为1.84 g·$mL^{-1}$,质量分数为98%的浓硫酸配制1 mol·$L^{-1}$的稀硫酸100 mL,需要用量筒量取该浓硫酸5.40 mL
C
)A.1 L水中溶解40 g NaOH固体后,所得溶液的物质的量浓度为1 mol·$L^{-1}$
B.配制1 L 0.2 mol·$L^{-1}的CuSO_{4}$溶液,需用32.0 g胆矾
C.将标准状况下2.24 L HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol·$L^{-1}$
D.用密度为1.84 g·$mL^{-1}$,质量分数为98%的浓硫酸配制1 mol·$L^{-1}$的稀硫酸100 mL,需要用量筒量取该浓硫酸5.40 mL
答案:
7. C [A.1L水溶解40gNaOH后,溶液体积不是1L,浓度不是1mol·L⁻¹,A错误;B.配制1L0.2mol·L⁻¹CuSO₄溶液,需胆矾质量为1L×0.2mol·L⁻¹×250g·mol⁻¹=50g,B错误;C.标准状况下2.24LHCl的物质的量为0.1mol,溶于水制成100mL溶液,浓度为$\frac{0.1mol}{0.1L}$=1mol·L⁻¹,C正确;D.浓硫酸的物质的量浓度为$\frac{1000×1.84×98\%}{98}$=18.4mol·L⁻¹,配制100mL1mol·L⁻¹稀硫酸,需浓硫酸体积为$\frac{1mol·L⁻¹×0.1L}{18.4mol·L⁻¹}$≈0.0054L=5.4mL,量筒读数保留一位小数,应为5.4mL,D错误。]
8. (2024·山西大同高一月考)配制480 mL 1.0 mol·$L^{-1}$NaCl溶液,部分实验操作如图所示:
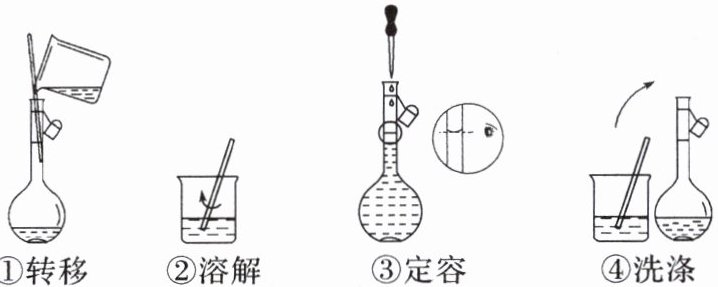
下列说法不正确的是(
A.实验中需要的仪器有天平、500 mL容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为②①④③
C.用托盘天平称量NaCl固体的质量为29.25 g
D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低

下列说法不正确的是(
C
)A.实验中需要的仪器有天平、500 mL容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为②①④③
C.用托盘天平称量NaCl固体的质量为29.25 g
D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
答案:
8. C [实验室没有480mL容量瓶,需用500mL容量瓶,A正确;操作步骤为计算、称量、溶解、转移、洗涤、定容、摇匀,图中②为称量,①为溶解,④为转移,③为定容,顺序为②①④③,B正确;需称量NaCl质量为0.5L×1.0mol·L⁻¹×58.5g·mol⁻¹=29.25g,但托盘天平只能精确到0.1g,应称量29.3g,C错误;定容时仰视刻度线,溶液体积偏大,浓度偏低,D正确。]
9. 完成下列计算:
(1)硫原子的摩尔质量是
(2)0.5 mol $H_{2}SO_{4}$的质量是
(3)含0.4 mol $Cl^{-}$的氯化镁是
(4)0.3 mol $NH_{3}$和0.4 mol $CO_{2}$的质量之比为
(5)已知4.8 g某混合气体含分子数为$0.15N_{A}$,该气体的平均摩尔质量为
(1)硫原子的摩尔质量是
32g·mol⁻¹
。(2)0.5 mol $H_{2}SO_{4}$的质量是
49
g,含0.5Nₐ
个分子,含2
mol氧原子,能和1
mol NaOH完全反应。(3)含0.4 mol $Cl^{-}$的氯化镁是
0.2
mol,质量是19
g,它跟23.4
g氯化钠含有相同数目的$Cl^{-}$。(4)0.3 mol $NH_{3}$和0.4 mol $CO_{2}$的质量之比为
51:176
,所含原子数之比为1:1
。(5)已知4.8 g某混合气体含分子数为$0.15N_{A}$,该气体的平均摩尔质量为
32g·mol⁻¹
。
答案:
9.
(1)32g·mol⁻¹
(2)49 0.5Nₐ 2 1
(3)0.2 19 23.4
(4)51:176 1:1
(5)32g·mol⁻¹ 解析
(2)0.5molH₂SO₄的质量为0.5mol×98g·mol⁻¹=49g,含有的分子数为0.5Nₐ,含有的氧原子数为4×0.5Nₐ=2Nₐ,物质的量为2mol,共1molH⁺,故能和1molNaOH完全反应。
(3)1mol氯化镁中含有2mol氯离子,故含0.4molCl⁻的氯化镁是0.2mol,质量是0.2mol×95g·mol⁻¹=19g;与0.4mol氯化钠含有相同数目的Cl⁻,氯化钠的质量为0.4mol×58.5g·mol⁻¹=23.4g。
(4)0.3molNH₃和0.4molCO₂的质量之比为(0.3×17):(0.4×44)=51:176,所含原子数之比为(0.3×4):(0.4×3)=1:1。
(5)该混合气体的物质的量为$\frac{0.15Nₐ}{Nₐ}$=0.15mol,平均摩尔质量为$\frac{4.8g}{0.15mol}$=32g·mol⁻¹。
(1)32g·mol⁻¹
(2)49 0.5Nₐ 2 1
(3)0.2 19 23.4
(4)51:176 1:1
(5)32g·mol⁻¹ 解析
(2)0.5molH₂SO₄的质量为0.5mol×98g·mol⁻¹=49g,含有的分子数为0.5Nₐ,含有的氧原子数为4×0.5Nₐ=2Nₐ,物质的量为2mol,共1molH⁺,故能和1molNaOH完全反应。
(3)1mol氯化镁中含有2mol氯离子,故含0.4molCl⁻的氯化镁是0.2mol,质量是0.2mol×95g·mol⁻¹=19g;与0.4mol氯化钠含有相同数目的Cl⁻,氯化钠的质量为0.4mol×58.5g·mol⁻¹=23.4g。
(4)0.3molNH₃和0.4molCO₂的质量之比为(0.3×17):(0.4×44)=51:176,所含原子数之比为(0.3×4):(0.4×3)=1:1。
(5)该混合气体的物质的量为$\frac{0.15Nₐ}{Nₐ}$=0.15mol,平均摩尔质量为$\frac{4.8g}{0.15mol}$=32g·mol⁻¹。
查看更多完整答案,请扫码查看


