2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
2. (2024·吉林延边二中高一期中)在 $ 2A(g) + B(g) \rightleftharpoons 3C(g) + 4D(g) $ 反应中,表示该反应速率最快的是( )
A.$ v(A) = 1.5 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{min}^{-1} $
B.$ v(B) = 1.8 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{min}^{-1} $
C.$ v(C) = 0.08 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{s}^{-1} $
D.$ v(D) = 0.1 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{s}^{-1} $
A.$ v(A) = 1.5 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{min}^{-1} $
B.$ v(B) = 1.8 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{min}^{-1} $
C.$ v(C) = 0.08 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{s}^{-1} $
D.$ v(D) = 0.1 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{s}^{-1} $
答案:
2. B [因同一反应用不同物质表示时,速率可能不同,所以比较反应速率时,应使用同一种物质。我们以 B 物质为参照物,将其他选项都转化为用 B 表示的反应速率。A 项,$v(A)=1.5mol·L^{-1}·min^{-1}$,则 $v(B)=0.75mol·L^{-1}·min^{-1}$;B 项,$v(B)=1.8mol·L^{-1}·min^{-1}$;C 项,$v(C)=0.08mol·L^{-1}·s^{-1}=4.8mol·L^{-1}·min^{-1}$,则 $v(B)=1.6mol·L^{-1}·min^{-1}$;D 项,$v(D)=0.1mol·L^{-1}·s^{-1}=6mol·L^{-1}·min^{-1}$,则 $v(B)=1.5mol·L^{-1}·min^{-1}$,故 B 项速率最快。]
3. (2024·江苏丹阳高一期中)用锌片与 $ 1 \, \text{mol} \cdot \text{L}^{-1} $ 稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
A.加入少量氯化钠溶液
B.对该反应体系加热
C.不用锌片,改用锌粉
D.加入少量 $ 2 \, \text{mol} \cdot \text{L}^{-1} $ 硫酸
A.加入少量氯化钠溶液
B.对该反应体系加热
C.不用锌片,改用锌粉
D.加入少量 $ 2 \, \text{mol} \cdot \text{L}^{-1} $ 硫酸
答案:
3. A [加入少量氯化钠溶液,溶液体积增大,$c(H^{+})$减小,氢气生成速率减慢,A 正确。]
4. (2024·广东江门高一段考)下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
A.Cu 能与浓硝酸反应,而不与浓盐酸反应
B.Cu 与浓硝酸反应比与稀硝酸反应快
C.$ N_2 $ 与 $ O_2 $ 在常温、常压下不反应,放电时可反应
D.加热时,$ MnO_2 $ 与浓盐酸反应,而不与稀盐酸反应
A.Cu 能与浓硝酸反应,而不与浓盐酸反应
B.Cu 与浓硝酸反应比与稀硝酸反应快
C.$ N_2 $ 与 $ O_2 $ 在常温、常压下不反应,放电时可反应
D.加热时,$ MnO_2 $ 与浓盐酸反应,而不与稀盐酸反应
答案:
4. A [A 项,与硝酸、盐酸的氧化性有关,反应速率由物质本身的性质决定;B 项,硝酸的浓度不同,反应速率不同,浓度为外因;C 项,常温、常压下及放电均为反应条件,为外因;D 项,浓盐酸与稀盐酸浓度不同,为外因。]
5. 已知 $ 4A + 5B = 2C + 6D $,则关于反应速率正确的关系是( )
A.$ 4v(A) = 5v(B) $
B.$ 5v(B) = 6v(D) $
C.$ 2v(A) = 3v(D) $
D.$ 2v(B) = 5v(C) $
A.$ 4v(A) = 5v(B) $
B.$ 5v(B) = 6v(D) $
C.$ 2v(A) = 3v(D) $
D.$ 2v(B) = 5v(C) $
答案:
5. D [A 项,$4v(A)=5v(B)$,则 $\frac{v(A)}{v(B)}=\frac{5}{4}$,速率之比不等于化学计量数之比,A 错误;$5v(B)=6v(D)$,则 $\frac{v(B)}{v(D)}=\frac{6}{5}$,速率之比不等于化学计量数之比,B 错误;$2v(A)=3v(D)$,则 $\frac{v(A)}{v(D)}=\frac{3}{2}$,速率之比不等于化学计量数之比,C 错误;$2v(B)=5v(C)$,则 $\frac{v(B)}{v(C)}=\frac{5}{2}$,速率之比等于化学计量数之比,D 正确。]
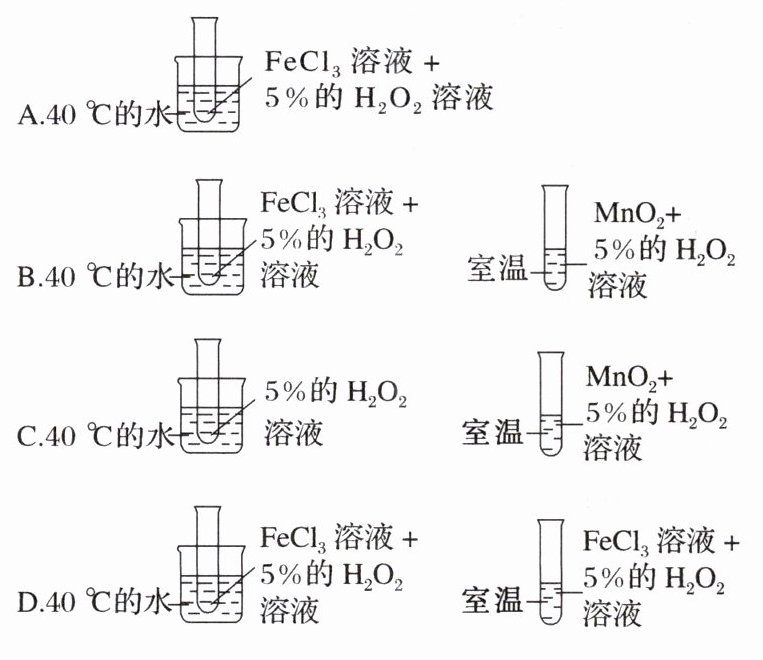
6. 为了探究温度对化学反应速率的影响,下列实验方案可行的是( )

答案:
6. D [没有对比实验,A 错误;催化剂不同,温度不同,无法比较,B 错误;前者没有催化剂,后者有催化剂,无法比较,C 错误;只有温度不同,其他条件都相同,该方案可行,D 正确。]
7. 对于 $ 300 \, \text{mL} \, 1 \, \text{mol} \cdot \text{L}^{-1} $ 盐酸与铁片的反应,采取下列措施,其中能使反应速率加快的是(
① 升高温度 ② 改用 $ 100 \, \text{mL} \, 3 \, \text{mol} \cdot \text{L}^{-1} $ 盐酸 ③ 再加 $ 300 \, \text{mL} \, 1 \, \text{mol} \cdot \text{L}^{-1} $ 盐酸 ④ 用等量铁粉代替铁片 ⑤ 改用 $ 100 \, \text{mL} \, 98\% $ 的硫酸
A.①②④
B.①③④
C.②③④
D.①②③⑤
A
) ① 升高温度 ② 改用 $ 100 \, \text{mL} \, 3 \, \text{mol} \cdot \text{L}^{-1} $ 盐酸 ③ 再加 $ 300 \, \text{mL} \, 1 \, \text{mol} \cdot \text{L}^{-1} $ 盐酸 ④ 用等量铁粉代替铁片 ⑤ 改用 $ 100 \, \text{mL} \, 98\% $ 的硫酸
A.①②④
B.①③④
C.②③④
D.①②③⑤
答案:
7. A [①升高温度,化学反应速率加快;②改用 $100mL 3mol·L^{-1}$ 盐酸,增大反应物盐酸的浓度,化学反应速率加快;③再加 $300mL 1mol·L^{-1}$ 盐酸,盐酸浓度相同,对化学反应速率无影响;④若用等量铁粉代替铁片,增大了铁与盐酸的接触面积,化学反应速率加快;⑤若改用 $98\%$的硫酸,在室温下 Fe 在浓硫酸中会发生钝化;综上分析,其中能使反应速率加快的是①②④,故选 A。]
8. $ CaCO_3 $ 与稀盐酸反应(放热反应)生成 $ CO_2 $ 的量与反应时间的关系如图所示。下列结论不正确的是(
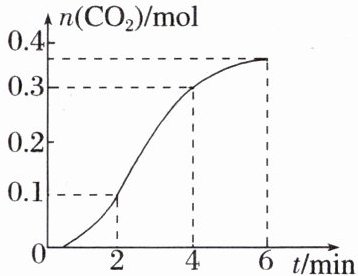
A.$ 0 \sim 4 \, \text{min} $ 内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是 $ c(\text{H}^+) $ 减小
C.反应在 $ 2 \sim 4 \, \text{min} $ 内平均反应速率最大
D.反应在 $ 2 \sim 4 \, \text{min} $ 内生成 $ CO_2 $ 的平均反应速率为 $ v(CO_2) = 0.06 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{s}^{-1} $
D
)
A.$ 0 \sim 4 \, \text{min} $ 内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是 $ c(\text{H}^+) $ 减小
C.反应在 $ 2 \sim 4 \, \text{min} $ 内平均反应速率最大
D.反应在 $ 2 \sim 4 \, \text{min} $ 内生成 $ CO_2 $ 的平均反应速率为 $ v(CO_2) = 0.06 \, \text{mol} \cdot \text{L}^{-1} \cdot \text{s}^{-1} $
答案:
8. D [随着反应的进行,$c(H^{+})$减小,而前 4 min 内反应速率变大,根据反应是放热反应,可推出前 4 min 内温度对反应速率的影响比浓度大,A、B 项正确;在 $2 ~ 4min$ 内 $n(CO_{2})$ 的变化量最大(或曲线的斜率最大),可判断出平均反应速率最大,C 项正确;由题意及图像可知,该题不知道容器体积,故不能计算出用浓度变化表示的反应速率,D 项错误。]
9. (2024·山西运城高一检测)为比较 $ \text{Fe}^{3+} $ 和 $ \text{Cu}^{2+} $ 对 $ \text{H}_2\text{O}_2 $ 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
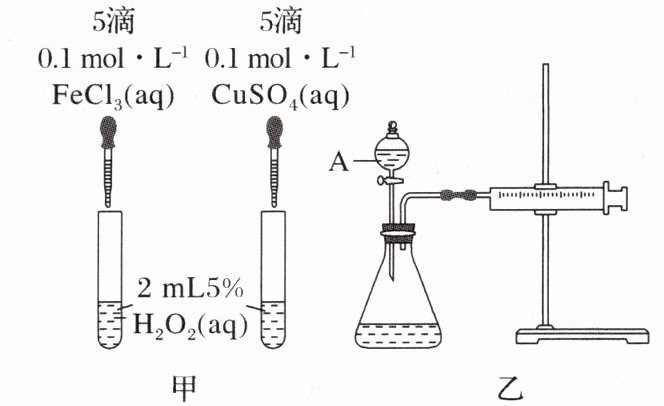
(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成 $ 40 \, \text{mL} $ 气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是
(3)查阅资料得知:将作为催化剂的 $ \text{Fe}_2(\text{SO}_4)_3 $ 溶液加入 $ \text{H}_2\text{O}_2 $ 溶液后,溶液中会发生两个氧化还原反应,且两个反应中 $ \text{H}_2\text{O}_2 $ 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是 $ 2\text{Fe}^{3+} + \text{H}_2\text{O}_2 = 2\text{Fe}^{2+} + \text{O}_2 \uparrow + 2\text{H}^+ $ 和

(1)定性分析:如图甲可通过观察
产生气泡
的快慢,定性比较得出结论。有同学提出将 $ 0.1 \, \text{mol} \cdot \text{L}^{-1} \, \text{FeCl}_3 $ 改为0.05
$ \text{mol} \cdot \text{L}^{-1} \, \text{Fe}_2(\text{SO}_4)_3 $ 更为合理,其理由是排除阴离子差异的干扰
。(2)定量分析:如图乙所示,实验时均以生成 $ 40 \, \text{mL} $ 气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是
产生 40 mL 气体需要的时间
。(3)查阅资料得知:将作为催化剂的 $ \text{Fe}_2(\text{SO}_4)_3 $ 溶液加入 $ \text{H}_2\text{O}_2 $ 溶液后,溶液中会发生两个氧化还原反应,且两个反应中 $ \text{H}_2\text{O}_2 $ 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是 $ 2\text{Fe}^{3+} + \text{H}_2\text{O}_2 = 2\text{Fe}^{2+} + \text{O}_2 \uparrow + 2\text{H}^+ $ 和
$2Fe^{2+}+H_{2}O_{2}+2H^{+}=2Fe^{3+}+2H_{2}O$
。
答案:
9.
(1)产生气泡 0.05 排除阴离子差异的干扰
(2)产生 40 mL 气体需要的时间
(3)$2Fe^{2+}+H_{2}O_{2}+2H^{+}=2Fe^{3+}+2H_{2}O$
解析
(1)$H_{2}O_{2}$ 在催化剂的作用下分解生成气体,所以可以通过观察产生气泡的快慢来判断两种催化剂的效果;两种溶液阴离子不相同,$SO_{4}^{2-}$ 和 $Cl^{-}$ 是否有催化效果也未知,所以为了排除阴离子差异的干扰,需要将 $0.1mol·L^{-1}FeCl_{3}$ 换为 $0.05mol·L^{-1}Fe_{2}(SO_{4})_{3}$,以确保 $Fe^{3+}$ 的量和 $Cu^{2+}$ 的量相同。
(2)根据题意说明影响催化剂效果的数据只能是收集相同体积的气体所需要的时间,故需要测量生成 40 mL 气体所需要的时间。
(3)催化剂在整个化学反应中,参加了反应,但质量与性质不变,总反应为 $2H_{2}O_{2}=2H_{2}O + O_{2}↑$,用总反应减去给出的离子方程式就可以得到另一个离子方程式:$2Fe^{2+}+H_{2}O_{2}+2H^{+}=2Fe^{3+}+2H_{2}O$。
(1)产生气泡 0.05 排除阴离子差异的干扰
(2)产生 40 mL 气体需要的时间
(3)$2Fe^{2+}+H_{2}O_{2}+2H^{+}=2Fe^{3+}+2H_{2}O$
解析
(1)$H_{2}O_{2}$ 在催化剂的作用下分解生成气体,所以可以通过观察产生气泡的快慢来判断两种催化剂的效果;两种溶液阴离子不相同,$SO_{4}^{2-}$ 和 $Cl^{-}$ 是否有催化效果也未知,所以为了排除阴离子差异的干扰,需要将 $0.1mol·L^{-1}FeCl_{3}$ 换为 $0.05mol·L^{-1}Fe_{2}(SO_{4})_{3}$,以确保 $Fe^{3+}$ 的量和 $Cu^{2+}$ 的量相同。
(2)根据题意说明影响催化剂效果的数据只能是收集相同体积的气体所需要的时间,故需要测量生成 40 mL 气体所需要的时间。
(3)催化剂在整个化学反应中,参加了反应,但质量与性质不变,总反应为 $2H_{2}O_{2}=2H_{2}O + O_{2}↑$,用总反应减去给出的离子方程式就可以得到另一个离子方程式:$2Fe^{2+}+H_{2}O_{2}+2H^{+}=2Fe^{3+}+2H_{2}O$。
查看更多完整答案,请扫码查看


