2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
10. 肼 $ (H_{2}N-NH_{2}) $ 是一种高能燃料,共价键的键能与热化学方程式信息如表:
|共价键| $ N-H $ | $ N-N $ | $ O= O $ | $ N≡N $ | $ O-H $ |
|键能/ $ (kJ\cdot mol^{-1}) $ | 391 | 161 | 498 | 946 | 463 |
则关于反应 $ N_{2}H_{4}(g)+O_{2}(g)= N_{2}(g)+2H_{2}O(g) $ 说法正确的是(
A.等质量的 $ N_{2}H_{4}(l) $ 比 $ N_{2}H_{4}(g) $ 能量高
B.该反应是吸热反应
C.$ N-H $ 比 $ O-H $ 稳定
D.反应物总键能小于生成物总键能
|共价键| $ N-H $ | $ N-N $ | $ O= O $ | $ N≡N $ | $ O-H $ |
|键能/ $ (kJ\cdot mol^{-1}) $ | 391 | 161 | 498 | 946 | 463 |
则关于反应 $ N_{2}H_{4}(g)+O_{2}(g)= N_{2}(g)+2H_{2}O(g) $ 说法正确的是(
D
)A.等质量的 $ N_{2}H_{4}(l) $ 比 $ N_{2}H_{4}(g) $ 能量高
B.该反应是吸热反应
C.$ N-H $ 比 $ O-H $ 稳定
D.反应物总键能小于生成物总键能
答案:
D [相同质量的同种物质,气态所具有的能量高于液态所具有的能量,因此$N_{2}H_{4}(l)$比$N_{2}H_{4}(g)$能量低,故 A 错误;根据方程式$N_{2}H_{4}(g)+O_{2}(g)=N_{2}(g)+2H_{2}O(g)$得到断键吸收的热量为$391kJ×4+161kJ×2+498kJ=2223kJ$,成键放出的热量为$946kJ+463kJ×4=2798kJ$,断键吸收的热量小于成键放出的热量,则该反应是放热反应,故 B 错误;根据 N—H 键能和 O—H 键能得到 N—H 不如 O—H 稳定,故 C 错误;该反应是放热反应,则反应物总键能小于生成物总键能,故 D 正确。]
11. $ N_{2} $ 和 $ H_{2} $ 在催化剂表面合成氨的微观历程及能量变化的示意图如图,用分别表示 $ N_{2}、H_{2}、NH_{3} $,已知: $ N_{2}(g)+3H_{2}(g)= 2NH_{3}(g) $,该反应属于放热反应。下列说法不正确的是(
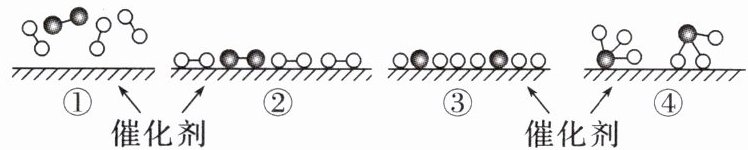
A.$ ②→③ $ 过程,是吸热过程
B.$ ③→④ $ 过程,N 原子和 H 原子形成了含有极性键的 $ NH_{3} $
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
C
)
A.$ ②→③ $ 过程,是吸热过程
B.$ ③→④ $ 过程,N 原子和 H 原子形成了含有极性键的 $ NH_{3} $
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
答案:
C [②→③过程是断开化学键,是吸热过程,故 A 正确;③→④过程是形成化学键,N原子和 H 原子形成了含有极性键的$NH_{3}$,故 B 正确;合成氨反应是放热反应,则反应物断键吸收的能量小于生成物形成新键释放的总能量,故 C 错误;合成氨反应是放热反应,则反应物总能量大于生成物总能量,故 D 正确。]
12. 图表示的是 $ 1molN_{2}(g) $ 和 $ 1molO_{2}(g) $ 反应生成 $ 2molNO(g) $ 过程中的能量变化情况,已知整个过程中共吸收 180kJ 的能量,下列说法正确的是(
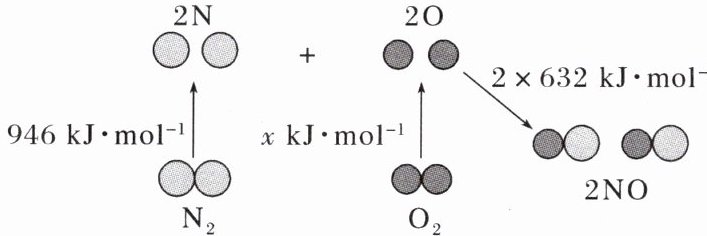
A.$ 2molO $ 原子生成 $ 1molO_{2}(g) $ 时放出 498kJ 能量
B.$ 2molNO(g) $ 分子中的化学键形成时需要吸收 1264kJ 能量
C.$ 1molN_{2}(g) $ 和 $ 1molO_{2}(g) $ 的总能量大于 $ 2molNO(g) $ 的能量
D.$ 1molN_{2}(g) $ 和 $ 1molO_{2}(g) $ 在放电条件和高温条件下分别反应生成 $ 2molNO(g) $ 时吸收的能量不同
A
) 
A.$ 2molO $ 原子生成 $ 1molO_{2}(g) $ 时放出 498kJ 能量
B.$ 2molNO(g) $ 分子中的化学键形成时需要吸收 1264kJ 能量
C.$ 1molN_{2}(g) $ 和 $ 1molO_{2}(g) $ 的总能量大于 $ 2molNO(g) $ 的能量
D.$ 1molN_{2}(g) $ 和 $ 1molO_{2}(g) $ 在放电条件和高温条件下分别反应生成 $ 2molNO(g) $ 时吸收的能量不同
答案:
A [已知整个过程中共吸收 180 kJ 的能量,则$946+x-2×632=180$,解得$x=498,1molO_{2}(g)$吸收 498 kJ 能量形成$2molO$原子,原子结合形成分子的过程是放热过程,$2molO$原子结合生成$1molO_{2}(g)$时需要放出 498 kJ 能量,故 A 正确;化学键的形成释放能量,2mol NO(g)分子中的化学键形成时放出$1264kJ$能量,故 B 错误;已知整个过程中共吸收 180 kJ能量,则该反应为吸热反应,反应物所具有的总能量低于生成物所具有的总能量,即$1molN_{2}(g)$和$1molO_{2}(g)$的总能量小于$2molNO(g)$的能量,故 C 错误;反应过程中的能量变化与反应条件无关,在放电条件和高温条件下,$1molN_{2}(g)$和$1molO_{2}(g)$反应生成$2molNO(g)$时吸收的能量相同,故 D 错误。]
Ⅰ.$(1)$下列物质本身具有的能量最低的是
$(2)$下列氢化物中最稳定的是
$(3) X_{2}(g)+H_{2}(g)= 2HX(g)(X $代表$ Cl、$$Br、$$I) $的反应是
$(4)$相同条件下$, X_{2}(X $代表$ Cl、$$Br、$$I) $分别与氢气反应$,$当消耗等物质的量的氢气时$,$放出或吸收的热量最多的是
Ⅱ.已知白磷和$ P_{4}O_{6} $的分子结构如图所示$,$现提供以下化学键的键能$ [$通常把拆开$($或形成$) 1mol $化学键吸收$($或放出$)$的能量称为键能$]$:$ P-P $为$ 198kJ\cdot mol^{-1}、$$P-O $为$ 360kJ\cdot mol^{-1}、$$O= O $为$ 498kJ\cdot mol^{-1} 。$则$ P_{4}($ $) $白磷$, s)+3O_{2}(g)= P_{4}O_{6}(s) $的反应是
A
。$(2)$下列氢化物中最稳定的是
A
。$(3) X_{2}(g)+H_{2}(g)= 2HX(g)(X $代表$ Cl、$$Br、$$I) $的反应是
放热反应
。$(4)$相同条件下$, X_{2}(X $代表$ Cl、$$Br、$$I) $分别与氢气反应$,$当消耗等物质的量的氢气时$,$放出或吸收的热量最多的是
$Cl_{2}$
。Ⅱ.已知白磷和$ P_{4}O_{6} $的分子结构如图所示$,$现提供以下化学键的键能$ [$通常把拆开$($或形成$) 1mol $化学键吸收$($或放出$)$的能量称为键能$]$:$ P-P $为$ 198kJ\cdot mol^{-1}、$$P-O $为$ 360kJ\cdot mol^{-1}、$$O= O $为$ 498kJ\cdot mol^{-1} 。$则$ P_{4}($ $) $白磷$, s)+3O_{2}(g)= P_{4}O_{6}(s) $的反应是
放热
反应$,$生成$ 1molP_{4}O_{6} $放出的热量为1638 kJ
。
答案:
Ⅰ.
(1)A
(2)A
(3)放热反应
(4)$Cl_{2}$Ⅱ.放热 1 638 kJ
解析 Ⅰ.
(1)
(2)破坏1mol物质中的化学键所吸收的能量越大,则物质越稳定,所具有的能量越低。
(3)
(4)以氯元素为例计算断开$1molCl—Cl$和 H—H 需吸收能量:$243kJ+436kJ=679kJ$,而形成$2molHCl$放出的能量为$2×432kJ=864kJ$,所以在$Cl_{2}(g)+H_{2}(g)=2HCl(g)$反应中放出$864kJ-679kJ=185kJ$的热量,同理可计算在$Br_{2}(g)+H_{2}(g)=2HBr(g)$、$I_{2}(g)+H_{2}(g)=2HI(g)$反应中,分别放出 103 kJ、9 kJ 的热量。Ⅱ.断开旧键吸收的能量为$6×198kJ+3×498kJ=2682kJ$,形成新键放出的能量为$12×360kJ=4320kJ$,故该反应为放热反应,生成$1molP_{4}O_{6}$放出的热量为$4320kJ-2682kJ=1638kJ$。
(1)A
(2)A
(3)放热反应
(4)$Cl_{2}$Ⅱ.放热 1 638 kJ
解析 Ⅰ.
(1)
(2)破坏1mol物质中的化学键所吸收的能量越大,则物质越稳定,所具有的能量越低。
(3)
(4)以氯元素为例计算断开$1molCl—Cl$和 H—H 需吸收能量:$243kJ+436kJ=679kJ$,而形成$2molHCl$放出的能量为$2×432kJ=864kJ$,所以在$Cl_{2}(g)+H_{2}(g)=2HCl(g)$反应中放出$864kJ-679kJ=185kJ$的热量,同理可计算在$Br_{2}(g)+H_{2}(g)=2HBr(g)$、$I_{2}(g)+H_{2}(g)=2HI(g)$反应中,分别放出 103 kJ、9 kJ 的热量。Ⅱ.断开旧键吸收的能量为$6×198kJ+3×498kJ=2682kJ$,形成新键放出的能量为$12×360kJ=4320kJ$,故该反应为放热反应,生成$1molP_{4}O_{6}$放出的热量为$4320kJ-2682kJ=1638kJ$。
查看更多完整答案,请扫码查看


