2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
3. 下列说法正确的是 (
A.任何物质中均存在化学键
B.氯气分子间的范德华力与氯气分子熔沸点高低无关
C.水结成冰密度减小与水分子之间能形成氢键有关
D.由不同种非金属元素的原子形成的共价化合物一定只含极性键
C
)A.任何物质中均存在化学键
B.氯气分子间的范德华力与氯气分子熔沸点高低无关
C.水结成冰密度减小与水分子之间能形成氢键有关
D.由不同种非金属元素的原子形成的共价化合物一定只含极性键
答案:
3. C [A.稀有气体的分子中不存在化学键,所以并不是所有物质中都存在化学键,故A错误;B.氯气分子是分子晶体,分子间的范德华力与氯气分子熔沸点高低有关,故B错误;C.液态时水分子杂乱无章,氢键的相对束缚力较小,空间排列无序,而结成冰以后,由于氢键作用多个水分子结合在一起形成类似于网状结构,占有的空间变大,体积变大,故密度变小,故C正确;D.由不同种非金属元素的原子形成的共价化合物如H₂O₂(结构式为H - O - O - H)含极性键和非极性键,故D错误。]
4. 下列关于共价键与共价化合物的叙述正确的是(
①含金属元素的化合物一定不是共价化合物
②共价化合物中一定只含有共价键
③共价化合物中一定不含离子键
④含有共价键的化合物一定是共价化合物
⑤离子化合物中可能含有共价键
A.②③⑤
B.②③④⑤
C.②③④
D.①②③⑤
A
)①含金属元素的化合物一定不是共价化合物
②共价化合物中一定只含有共价键
③共价化合物中一定不含离子键
④含有共价键的化合物一定是共价化合物
⑤离子化合物中可能含有共价键
A.②③⑤
B.②③④⑤
C.②③④
D.①②③⑤
答案:
4. A [含金属元素的化合物可能是共价化合物,如氯化铝,①错误;共价化合物中只含有共价键,一定不含离子键,②③正确;离子化合物中可能含有共价键,如氢氧化钠含有离子键和共价键,⑤正确。]
5. 下列各组物质中,化学键类型完全相同的是 (
A.HI 和 NaI
$B.H_2S $和$ CO_2$
C.NaCl 和$ CCl_4$
$D.Na_2O_2 $和 NaOH
B
)A.HI 和 NaI
$B.H_2S $和$ CO_2$
C.NaCl 和$ CCl_4$
$D.Na_2O_2 $和 NaOH
答案:
5. B [A项,HI含有共价键,NaI含有离子键,化学键类型不同;B项,H₂S和CO₂都只含有极性共价键;C项,NaCl含有离子键,CCl₄含有极性键,化学键类型不同;D项,Na₂O₂含有离子键和非极性共价键,NaOH含有离子键和极性键。]
6. 下列结论错误的是 (
①氢化物的稳定性:$HF>HCl>H_2S>PH_3>SiH_4$
②离子的还原性:$S^2⁻>Cl⁻>Br⁻>I⁻$
③氧化性:$Cl_2>S>Se>Te$
④酸性:$H_2SO_4>H_3PO_4>H_2CO_3>HClO$
⑤非金属性:O>N>P>Si
⑥金属性:Be<Mg<Ca<K
A.只有②
B.②④⑦
C.②④⑤⑥
D.①③⑤
A
)①氢化物的稳定性:$HF>HCl>H_2S>PH_3>SiH_4$
②离子的还原性:$S^2⁻>Cl⁻>Br⁻>I⁻$
③氧化性:$Cl_2>S>Se>Te$
④酸性:$H_2SO_4>H_3PO_4>H_2CO_3>HClO$
⑤非金属性:O>N>P>Si
⑥金属性:Be<Mg<Ca<K
A.只有②
B.②④⑦
C.②④⑤⑥
D.①③⑤
答案:
6. A [①同主族元素从上到下非金属性减弱,同周期元素从左到右非金属性增强。元素非金属性F > Cl > S > P > Si,非金属性越强气态氢化物越稳定,氢化物的稳定性:HF > HCl > H₂S > PH₃ > SiH₄,故①正确;②离子的还原性:Cl⁻
S > Se > Te,元素非金属性越强,其单质氧化性越强,氧化性:Cl₂ > S > Se > Te,故③正确;④元素非金属性越强,最高价含氧酸的酸性越强,酸性H₂SO₄ > H₃PO₄ > H₂CO₃,次氯酸不是最高价含氧酸,次氯酸的酸性小于碳酸,所以酸性:H₂SO₄ > H₃PO₄ > H₂CO₃ > HClO,故④正确;⑤同主族元素从上到下非金属性减弱,同周期元素从左到右非金属性增强,非金属性O > N > P > Si,故⑤正确;⑥同主族元素从上到下金属性增强,同周期元素从左到右金属性减弱,金属性Be < Mg < Ca < K,故⑥正确;错误的只有②,选A。]
S > Se > Te,元素非金属性越强,其单质氧化性越强,氧化性:Cl₂ > S > Se > Te,故③正确;④元素非金属性越强,最高价含氧酸的酸性越强,酸性H₂SO₄ > H₃PO₄ > H₂CO₃,次氯酸不是最高价含氧酸,次氯酸的酸性小于碳酸,所以酸性:H₂SO₄ > H₃PO₄ > H₂CO₃ > HClO,故④正确;⑤同主族元素从上到下非金属性减弱,同周期元素从左到右非金属性增强,非金属性O > N > P > Si,故⑤正确;⑥同主族元素从上到下金属性增强,同周期元素从左到右金属性减弱,金属性Be < Mg < Ca < K,故⑥正确;错误的只有②,选A。]
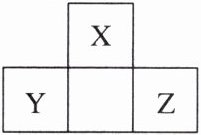
7. 短周期主族元素 X、Y、Z 在元素周期表中的相对位置如图所示,其中 Y 原子的电子总数等于其最外层电子数的 3 倍。下列说法正确的是 (
A.最高正化合价:Z>X>Y
B.Z 的单质具有漂白性
C.Z 的最高价氧化物为$ ZO_3$
D.简单氢化物的稳定性:Y<Z
D
)
A.最高正化合价:Z>X>Y
B.Z 的单质具有漂白性
C.Z 的最高价氧化物为$ ZO_3$
D.简单氢化物的稳定性:Y<Z
答案:
7. D [Y原子的电子总数等于其最外层电子数的3倍,X、Y、Z为短周期元素,则Y位于第三周期,设Y原子最外层电子数为a,则2 + 8 + a = 3a,解得a = 5,则Y为P,Z为Cl,X为O,以此解答。X为O,无最高正化合价,Y为P,最高正价为 + 5,A错误;Z为Cl,氯气不具有漂白性,起漂白作用的是HClO,B错误;Z为Cl,最高正价为 + 7,最高价氧化物为Cl₂O₇,C错误;Y为P,Z为Cl,同周期主族元素从左到右非金属性逐渐增强,非金属性:P < Cl,简单氢化物的稳定性:PH₃ < HCl,D正确。]
8. 短周期主族元素 R、W、X、Y、Z 的原子序数依次增大,最外层电子数之和为 20,其中三种是地壳中含量前三的元素,R、W、X 分别位于不同周期。下列说法错误的是 (
A.简单离子半径:X<W
B.简单氢化物的稳定性:W<Z
C.Y 的最高正化合价为+4
D.R 与 W 形成原子个数比为 1:1 的化合物中只存在共价键
B
)A.简单离子半径:X<W
B.简单氢化物的稳定性:W<Z
C.Y 的最高正化合价为+4
D.R 与 W 形成原子个数比为 1:1 的化合物中只存在共价键
答案:
8. B [地壳中含量前三的元素是氧、硅、铝,最外层电子数之和为20,R、W、X分别位于不同周期,由此推断出R、W、X、Y、Z分别为氢、氧、铝、硅、硫。A.简单离子半径:X、W分别为铝离子、氧离子,根据具有相同电子层结构的离子,核电荷数越小,离子半径越大,可知离子半径:X < W,A正确;B.简单氢化物的稳定性:水大于硫化氢,B错误;C.Y为硅,最高正化合价为 + 4,C正确;D.R与W形成原子个数比为1:1的化合物为过氧化氢,只存在共价键,D正确。]
9.(2024·兰州高一期末)按要求完成下列填空。
下列物质:$①N_2 ②H_2S ③NaOH ④Na_2O_2 ⑤CO_2 ⑥NH_4Cl ⑦H_2SO_4 ⑧NaHSO_4$
(1)含有共价键的离子化合物是
(2)属于共价化合物的是
(3)只含有非极性键的物质是
(4)写出①的结构式:
下列物质:$①N_2 ②H_2S ③NaOH ④Na_2O_2 ⑤CO_2 ⑥NH_4Cl ⑦H_2SO_4 ⑧NaHSO_4$
(1)含有共价键的离子化合物是
③④⑥⑧
(填序号,下同)。(2)属于共价化合物的是
②⑤⑦
。(3)只含有非极性键的物质是
①
。(4)写出①的结构式:
N≡N
,写出⑥的电子式:[H: \ddot{\text{N}} : H]⁺ [ : \ddot{\text{Cl}} : ]⁻
。
答案:
$9. (1)③④⑥⑧ (2)②⑤⑦ (3)①(4)N≡N [H: \ddot{\text{N}} : H]⁺ [ : \ddot{\text{Cl}} : ]⁻$
10. 最近科学家利用尿素$(H_2NCONH_2)$和$ H_2O_2 $形成化合物$ H_2NCONH_2·H_2O_2,$不但使$ H_2O_2 $稳定下来,且结构没有发生改变。已知$ H_2O_2 $的结构式为 H-O-O-H,下列说法错误的是 (
A.$H_2NCONH_2 $中含共价键、离子键
B.$H_2O_2 $分子的电子式为
C.$H_2O_2 $既有氧化性又有还原性
D.$H_2NCONH_2·H_2O_2 $属于共价化合物
A
)A.$H_2NCONH_2 $中含共价键、离子键
B.$H_2O_2 $分子的电子式为

C.$H_2O_2 $既有氧化性又有还原性
D.$H_2NCONH_2·H_2O_2 $属于共价化合物
答案:
10. A [H₂NCONH₂全部由非金属元素构成,且不含铵根离子,则只含共价键,不含离子键,A错误;H₂O₂分子的结构式为H - O - O - H,其电子式为$H: \ddot{\text{O}} : \ddot{\text{O}} : H,$B正确;H₂O₂中的氧元素为 - 1价,处于中间价态,化合价既可以升高也可以降低,则H₂O₂既有氧化性又有还原性,C正确;H₂NCONH₂与H₂O₂都是共价化合物,当形成H₂NCONH₂·H₂O₂时,结构没有发生改变,则H₂NCONH₂·H₂O₂也属于共价化合物,D正确。]
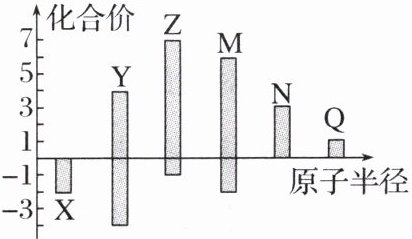
11.X、Y、Z、M、N、Q 皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是 (
A.金属性:N>Q
B.最高价氧化物对应水化物的酸性:M<Y
C.简单离子半径:Q>N>X
D.原子序数:Z>M>X>Y
D
)
A.金属性:N>Q
B.最高价氧化物对应水化物的酸性:M<Y
C.简单离子半径:Q>N>X
D.原子序数:Z>M>X>Y
答案:
11. D [根据示意图可知X只有 - 2价,是氧元素。Y的主要化合价是 - 4价和 + 4价,Z的最高价是 + 7价,Y原子半径大于氧原子,小于Z原子,所以Y是碳元素,Z是氯元素。M的主要化合价是 - 2价和 + 6价,原子半径大于氯原子,则M是硫元素。N的最高价是 + 3价,则N是铝元素。Q的主要化合价是 + 1价,原子半径最大,则Q是钠元素。金属性:Al < Na,A错误;非金属性:S > C,则酸性:H₂SO₄ > H₂CO₃,B错误;简单离子半径:O²⁻ > Na⁺ > Al³⁺,C错误;原子序数:Cl > S > O > C,即Z > M > X > Y,D正确。]
查看更多完整答案,请扫码查看


