2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
7. 关于煤和石油的综合利用,下列说法正确的是(
A.煤中含有甲苯、二甲苯等有机物,可以通过干馏得到
B.以煤为主要原料,可以合成甲醇
C.石油裂化的目的是获取短链不饱和气态烃
D.石油裂化生产的汽油不能使溴水褪色
B
)A.煤中含有甲苯、二甲苯等有机物,可以通过干馏得到
B.以煤为主要原料,可以合成甲醇
C.石油裂化的目的是获取短链不饱和气态烃
D.石油裂化生产的汽油不能使溴水褪色
答案:
7. B [煤中不含甲苯、二甲苯,它们是煤干馏后的产物,故 A 错误;煤可以通过间接液化合成甲醇,B 正确;石油裂化的目的是获取更多更好的轻质液体燃料,故 C 错误;裂化汽油中含有烯烃,能使溴水褪色,故 D 错误。]
8. 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是(
A.$NO_{2}和SO_{2}$均为红棕色且有刺激性气味的气体,是酸雨的主要成因
B.汽车尾气中的主要大气污染物为$NO$、$SO_{2}和PM_{2.5}$
C.植物直接吸收利用空气中的$NO和NO_{2}$作为肥料,实现氮的固定
D.工业废气中的$SO_{2}$可采用石灰法进行脱除
D
)A.$NO_{2}和SO_{2}$均为红棕色且有刺激性气味的气体,是酸雨的主要成因
B.汽车尾气中的主要大气污染物为$NO$、$SO_{2}和PM_{2.5}$
C.植物直接吸收利用空气中的$NO和NO_{2}$作为肥料,实现氮的固定
D.工业废气中的$SO_{2}$可采用石灰法进行脱除
答案:
8. D [NO₂是红棕色且有刺激性气味的气体,而 SO₂是无色有刺激性气味的气体,A 错误;汽车尾气中的主要大气污染物为碳与氮的氧化物,如 NOₓ和 CO 等,B 错误;氮的固定是指将游离态的氮转化为氮的化合物的过程,且植物可吸收土壤中的铵根离子或硝酸根离子作为肥料,不能直接吸收空气中的氮氧化物,C 错误。]
9. 生活处处离不开化学。阅读材料,完成各题:
材料一:人体胃液中含有胃酸($0.2\%\sim0.4\%$的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是$Al(OH)_{3}$]或“小苏打片”(主要成分是$NaHCO_{3}$)给病人治疗。
(1)写出$NaHCO_{3}$在水中的电离方程式:
(2)病人同时患有胃溃疡,此时最宜服用
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊溶液,溶液变红,说明维生素C的水溶液呈
A. 酸性 B. 碱性 C. 氧化性 D. 还原性
(4)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子转化成亚铁离子,有利于铁的吸收。上述反应中维生素C是
材料一:人体胃液中含有胃酸($0.2\%\sim0.4\%$的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是$Al(OH)_{3}$]或“小苏打片”(主要成分是$NaHCO_{3}$)给病人治疗。
(1)写出$NaHCO_{3}$在水中的电离方程式:
NaHCO₃ = Na⁺ + HCO₃⁻
。(2)病人同时患有胃溃疡,此时最宜服用
胃舒平
(填“小苏打片”或“胃舒平”),发生反应的化学方程式为Al(OH)₃ + 3HCl = AlCl₃ + 3H₂O
。材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊溶液,溶液变红,说明维生素C的水溶液呈
A
(填字母)。A. 酸性 B. 碱性 C. 氧化性 D. 还原性
(4)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子转化成亚铁离子,有利于铁的吸收。上述反应中维生素C是
还原
剂。
答案:
(1)NaHCO₃ = Na⁺ + HCO₃⁻
(2)胃舒平 Al(OH)₃ + 3HCl = AlCl₃ + 3H₂O
(3)A
(4)还原
(1)NaHCO₃ = Na⁺ + HCO₃⁻
(2)胃舒平 Al(OH)₃ + 3HCl = AlCl₃ + 3H₂O
(3)A
(4)还原
10. 从海带中提取碘单质,工艺流程如下。下列关于海带制碘的说法错误的是(
干海带$\xrightarrow{灼烧}海带灰\xrightarrow[浸泡]{沸水}悬浊液\xrightarrow{过滤}滤液\xrightarrow{H^{+},H_{2}O_{2}}碘水\xrightarrow{CCl_{4}}I_{2}的CCl_{4}$溶液
A.实验室灼烧干海带在坩埚中进行
B.沸水浸泡的目的是使$I^{-}$充分浸出
C.由滤液获得碘水,发生的离子反应为$2I^{-}+H_{2}O_{2}= I_{2}+2OH^{-}$
D.可以用淀粉溶液检验碘水中的$I_{2}$
C
)干海带$\xrightarrow{灼烧}海带灰\xrightarrow[浸泡]{沸水}悬浊液\xrightarrow{过滤}滤液\xrightarrow{H^{+},H_{2}O_{2}}碘水\xrightarrow{CCl_{4}}I_{2}的CCl_{4}$溶液
A.实验室灼烧干海带在坩埚中进行
B.沸水浸泡的目的是使$I^{-}$充分浸出
C.由滤液获得碘水,发生的离子反应为$2I^{-}+H_{2}O_{2}= I_{2}+2OH^{-}$
D.可以用淀粉溶液检验碘水中的$I_{2}$
答案:
10. C [干海带灼烧得到海带灰,沸水浸泡海带灰,过滤得到含有碘离子的滤液,加入酸化的过氧化氢溶液氧化碘离子生成碘单质,加入四氯化碳萃取分液得到碘的四氯化碳溶液。固体灼烧应在坩埚中进行,A 正确;沸水浸泡海带灰的目的是加快 I⁻的溶解,并使之溶解更充分,B 正确;由滤液获得碘水,正确的离子方程式为 2I⁻ + 2H⁺ + H₂O₂ = I₂ + 2H₂O,C 错误;淀粉遇 I₂变蓝,D 正确。]
11. 保罗·克拉兹等三位科学家因在氟利昂和臭氧层方面的研究获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示。下列说法不正确的是(
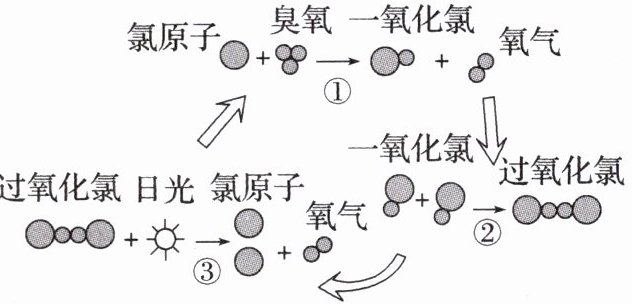
A.氯原子在反应中作催化剂
B.过氧化氯的结构式为$O-Cl-Cl-O$
C.臭氧分子最终转变成氧气分子
D.过程②中一氧化氯断键形成过氧化氯
B
)
A.氯原子在反应中作催化剂
B.过氧化氯的结构式为$O-Cl-Cl-O$
C.臭氧分子最终转变成氧气分子
D.过程②中一氧化氯断键形成过氧化氯
答案:
11. B [图中反应历程为①Cl + O₃ → ClO + O₂,②ClO + ClO → ClOOCl,③ClOOCl → 2Cl + O₂。该过程的总反应为 2O₃ = 3O₂,所以氯原子在反应中作催化剂,A 正确;过氧化氯的结构式为 Cl—O—O—Cl,B 错误;由该过程的总反应知臭氧分子最终转变成氧气分子,C 正确;过程②中 ClO + ClO → ClOOCl,一氧化氯断键形成过氧化氯,D 正确。]
12. 海水中溴元素以$Br^{-}$形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图: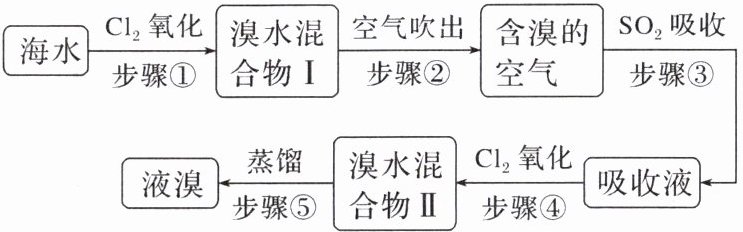
(1)步骤①反应的离子方程式是
(2)从理论上考虑,下列物质也能吸收$Br_{2}$的是
A. $NaOH$ B. $FeCl_{2}$ C. $Na_{2}SO_{3}$ D. $H_{2}O$
(3)步骤③中氧化剂是
(4)根据上述反应判断$SO_{2}$、$Cl_{2}$、$Br_{2}$三种物质氧化性由强到弱的顺序是

(1)步骤①反应的离子方程式是
2Br⁻ + Cl₂ = Br₂ + 2Cl⁻
;步骤③反应的化学方程式是SO₂ + Br₂ + 2H₂O = H₂SO₄ + 2HBr
。(2)从理论上考虑,下列物质也能吸收$Br_{2}$的是
ABC
。A. $NaOH$ B. $FeCl_{2}$ C. $Na_{2}SO_{3}$ D. $H_{2}O$
(3)步骤③中氧化剂是
Br₂
,若反应中生成$2molHBr$,则消耗1
$molSO_{2}$。(4)根据上述反应判断$SO_{2}$、$Cl_{2}$、$Br_{2}$三种物质氧化性由强到弱的顺序是
Cl₂ > Br₂ > SO₂
。
答案:
(1)2Br⁻ + Cl₂ = Br₂ + 2Cl⁻ SO₂ + Br₂ + 2H₂O = H₂SO₄ + 2HBr
(2)ABC
(3)Br₂ 1
(4)Cl₂ > Br₂ > SO₂ 解析
(1)由流程图和反应原理可写出步骤①反应的离子方程式和步骤②反应的化学方程式分别为 2Br⁻ + Cl₂ = Br₂ + 2Cl⁻,SO₂ + Br₂ + 2H₂O = 2HBr + H₂SO₄。
(2)从理论上考虑,NaOH 具有强碱性,能吸收 Br₂,Fe²⁺、SO₃²⁻具有强还原性也能吸收 Br₂。
(3)步骤③中发生的反应为 Br₂ + SO₂ + 2H₂O = H₂SO₄ + 2HBr,该反应中氧化剂为 Br₂,还原剂为 SO₂,反应中每生成 2 mol HBr,则消耗 1 mol SO₂,最后再向含 HBr 的溶液中通入适量 Cl₂ 蒸馏得到 Br₂。
(4)经过上述过程中的反应知氧化性由强到弱的顺序为 Cl₂ > Br₂ > SO₂。
(1)2Br⁻ + Cl₂ = Br₂ + 2Cl⁻ SO₂ + Br₂ + 2H₂O = H₂SO₄ + 2HBr
(2)ABC
(3)Br₂ 1
(4)Cl₂ > Br₂ > SO₂ 解析
(1)由流程图和反应原理可写出步骤①反应的离子方程式和步骤②反应的化学方程式分别为 2Br⁻ + Cl₂ = Br₂ + 2Cl⁻,SO₂ + Br₂ + 2H₂O = 2HBr + H₂SO₄。
(2)从理论上考虑,NaOH 具有强碱性,能吸收 Br₂,Fe²⁺、SO₃²⁻具有强还原性也能吸收 Br₂。
(3)步骤③中发生的反应为 Br₂ + SO₂ + 2H₂O = H₂SO₄ + 2HBr,该反应中氧化剂为 Br₂,还原剂为 SO₂,反应中每生成 2 mol HBr,则消耗 1 mol SO₂,最后再向含 HBr 的溶液中通入适量 Cl₂ 蒸馏得到 Br₂。
(4)经过上述过程中的反应知氧化性由强到弱的顺序为 Cl₂ > Br₂ > SO₂。
查看更多完整答案,请扫码查看


