2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 下列关于氮及其化合物,说法不正确的是 (
A.氮的固定是将$N_{2}$转化成含氮化合物
B.氮元素在自然界中既有游离态又有化合态
C.NO 和$NO_{2}$都可稳定存在于空气中
D.$N_{2}$既可作氧化剂又可作还原剂
C
)A.氮的固定是将$N_{2}$转化成含氮化合物
B.氮元素在自然界中既有游离态又有化合态
C.NO 和$NO_{2}$都可稳定存在于空气中
D.$N_{2}$既可作氧化剂又可作还原剂
答案:
C [A 项,氮的固定是将空气中游离态的氮转化为含氮化合物的过程,如与豆类植物共生的根瘤菌,能吸收大气中的氮气分子,将其转变成含氮化合物,正确;B 项,自然界中 N 有游离态,如 $ N_{2} $,也有化合态,如铵盐、硝酸盐等,正确;C 项,NO 不稳定,易与 $ O_{2} $ 反应生成 $ NO_{2} $,错误;D 项,$ N_{2} $ 中 N 元素为 0 价,处于氮的中间价态,化合价既可以升高又可以降低,$ N_{2} $ 既可以作氧化剂又可以作还原剂,D 正确。]
2. 试管中盛有少量白色固体,可能是铵盐,检验的方法是 (
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞溶液
D.加氢氧化钠溶液,加热,用蘸有浓硫酸的玻璃棒靠近试管口
B
)A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞溶液
D.加氢氧化钠溶液,加热,用蘸有浓硫酸的玻璃棒靠近试管口
答案:
B [铵盐加水仅溶解,不产生氨气,无法通过试纸检验,A 不符合题意;铵盐加碱再加热产生了 $ NH_{3} $,湿润的红色石蕊试纸遇 $ NH_{3} $ 变蓝,该方法可检验铵盐,B 项符合题意;氢氧化钠能使酚酞变红,产生的碱性物质也能使酚酞变红,该方法无法检验铵盐,C 项不符合题意;铵盐加入碱加热产生的 $ NH_{3} $ 遇挥发性的酸有白烟,但遇浓硫酸没有现象,D 项不符合题意。]
3. 向浅绿色的$Fe(NO_{3})_{2}$溶液中逐滴加入少量稀盐酸时,溶液的颜色变化应该是 (
A.颜色变浅
B.变为红色
C.没有改变
D.变为黄色
D
)A.颜色变浅
B.变为红色
C.没有改变
D.变为黄色
答案:
D [$ Fe(NO_{3})_{2} $ 溶液中加入稀盐酸时,$ H^{+} $ 和 $ NO_{3}^{-} $ 结合成具有强氧化性的稀硝酸,将浅绿色的 $ Fe^{2+} $ 氧化成黄色的 $ Fe^{3+} $,故选 D。]
4. 如图所示,试管中盛装的气体呈红棕色,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,对原试管中盛装的气体说法正确的是 (
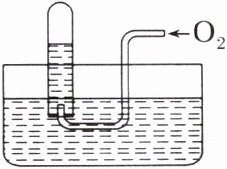
A.可能是$N_{2}与NO_{2}$的混合气体
B.可能是$N_{2}$与 NO 的混合气体
C.可能是 NO 与$NO_{2}$的混合气体
D.只可能是$NO_{2}$一种气体
C
) 
A.可能是$N_{2}与NO_{2}$的混合气体
B.可能是$N_{2}$与 NO 的混合气体
C.可能是 NO 与$NO_{2}$的混合气体
D.只可能是$NO_{2}$一种气体
答案:
C [试管中盛装的气体呈红棕色,那么一定有二氧化氮存在。根据题述现象可知,原试管中盛装的气体的成分可能为① $ NO_{2} $、② $ NO_{2} $ 和 $ O_{2} $(少量)、③ $ NO_{2} $ 和 NO 等。]
5. 下列对 NO 和$NO_{2}$的描述不正确的是 (
A.$NO_{2}$与水的反应中,$NO_{2}$既是氧化剂又是还原剂
B.NO 是无色气体,可用向上排空气法收集
C.$NO_{2}与H_{2}O反应生成HNO_{3}$,但$NO_{2}$不是酸性氧化物
D.从元素化合价角度看,NO 既有氧化性又有还原性
B
)A.$NO_{2}$与水的反应中,$NO_{2}$既是氧化剂又是还原剂
B.NO 是无色气体,可用向上排空气法收集
C.$NO_{2}与H_{2}O反应生成HNO_{3}$,但$NO_{2}$不是酸性氧化物
D.从元素化合价角度看,NO 既有氧化性又有还原性
答案:
B [$ NO_{2} $ 与水发生反应:$ 3NO_{2}+H_{2}O=2HNO_{3}+NO $,氮元素由 +4 价变为 +2 价和 +5 价,则 $ NO_{2} $ 既是氧化剂又是还原剂,A 正确;NO 易与 $ O_{2} $ 反应生成 $ NO_{2} $,不能用排空气法收集,可采用排水法收集,B 错误;$ NO_{2} $ 与 $ H_{2}O $ 反应生成 $ HNO_{3} $,N 的价态发生了变化,故 $ NO_{2} $ 不是酸性氧化物,C 正确;NO 中氮元素显 +2 价,处于中间价态,则 NO 既有氧化性又有还原性,D 正确。]
6. 下列有关硝酸化学性质的叙述正确的是 (
A.硝酸能与$Na_{2}SO_{3}$反应,但不生成$SO_{2}$
B.硝酸的氧化性很强,能氧化所有金属
C.可用铝或铁制容器盛装稀硝酸
D.浓硝酸因易挥发出$HNO_{3}$而呈黄色
A
)A.硝酸能与$Na_{2}SO_{3}$反应,但不生成$SO_{2}$
B.硝酸的氧化性很强,能氧化所有金属
C.可用铝或铁制容器盛装稀硝酸
D.浓硝酸因易挥发出$HNO_{3}$而呈黄色
答案:
A [硝酸与 $ Na_{2}SO_{3} $ 发生氧化还原反应,$ Na_{2}SO_{3} $ 被氧化生成 $ Na_{2}SO_{4} $,不会生成 $ SO_{2} $,A 正确;硝酸具有强氧化性,能氧化大部分金属,Au、Pt 等除外,B 错误;常温下,Fe、Al 均能与稀硝酸反应,不能用铝或铁制容器盛装稀硝酸,C 错误;浓硝酸见光或受热易分解,生成的 $ NO_{2} $ 溶于其中而使浓硝酸呈黄色,D 错误。]
7. (2024·湖南怀化高一期中)实验是化学研究的重要手段。如图是$NH_{3}$的两个性质实验,下列有关说法不正确的是 (
A.实验Ⅰ说明氨气易溶于水
B.实验Ⅰ形成喷泉的原因是烧瓶内压强小于外界大气压
C.实验Ⅱ可用于检验$NH_{3}$
D.只有实验Ⅱ表现了$NH_{3}$是碱性气体
D
)A.实验Ⅰ说明氨气易溶于水
B.实验Ⅰ形成喷泉的原因是烧瓶内压强小于外界大气压
C.实验Ⅱ可用于检验$NH_{3}$
D.只有实验Ⅱ表现了$NH_{3}$是碱性气体
答案:
D [氨气与水反应生成的 $ NH_{3}·H_{2}O $ 电离出氢氧根离子,溶液显碱性,实验Ⅰ也能说明氨气是碱性气体,故选 D。]
8. 某化学兴趣小组利用图 1 装置制取氨气并探究氨气的有关性质。
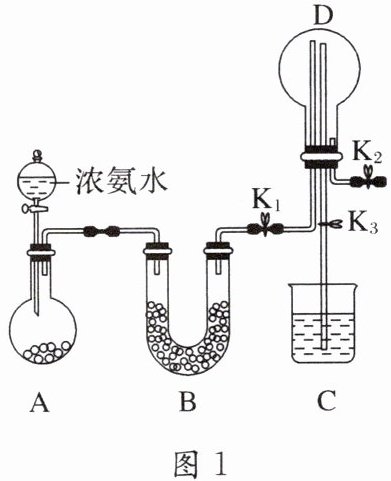
(1)装置 A 中烧瓶内试剂可选用
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱
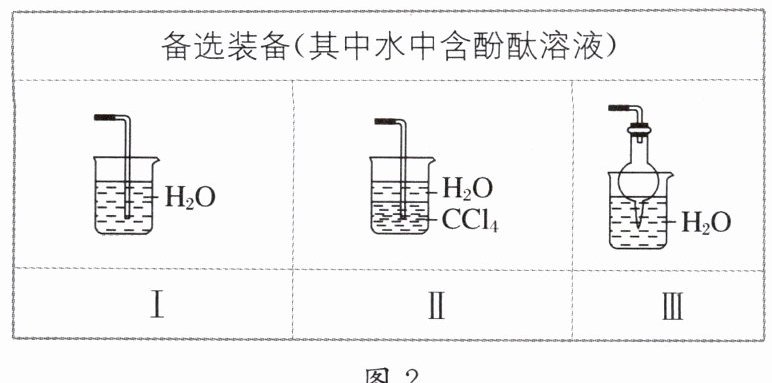
(2)若探究氨气的溶解性,需在$K_{2}$的导管末端连接图 2 装置中的
(3)若探究氨气的还原性,需打开$K_{1}$、$K_{3}$,$K_{2}$处导管连接制取纯净、干燥氯气的装置。D 中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为


(1)装置 A 中烧瓶内试剂可选用
ace
(填字母)。a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱
(2)若探究氨气的溶解性,需在$K_{2}$的导管末端连接图 2 装置中的
Ⅱ或Ⅲ
装置(填序号),当装置 D 中集满氨气后,关闭$K_{1}$、$K_{2}$,打开$K_{3}$,引发喷泉的实验操作是用热毛巾将烧瓶捂热(其他合理答案均可)
。(3)若探究氨气的还原性,需打开$K_{1}$、$K_{3}$,$K_{2}$处导管连接制取纯净、干燥氯气的装置。D 中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为
$3Cl_{2}+8NH_{3}=6NH_{4}Cl+N_{2}$
。
答案:
(1) ace
(2) Ⅱ或Ⅲ 用热毛巾将烧瓶捂热(其他合理答案均可)
(3) $ 3Cl_{2}+8NH_{3}=6NH_{4}Cl+N_{2} $ 解析
(1) 在浓氨水中存在平衡:$ NH_{3}+H_{2}O \rightleftharpoons NH_{3}·H_{2}O \rightleftharpoons NH_{4}^{+}+OH^{-} $,向其中加入生石灰 [发生反应生成 $ Ca(OH)_{2} $ ] 或烧碱,都会使平衡左移,同时放出大量的热促进氨水的挥发。碱石灰的成分是烧碱和生石灰,原理同上述,都可快速制备氨气。
(2) 氨气极易溶于水,不溶于 $ CCl_{4} $,需选择防倒吸装置进行实验探究,因此需选择图 2 中的Ⅱ或Ⅲ。根据喷泉实验的原理,要使装置 D 发生喷泉现象。用热毛巾将烧瓶捂热,可使 D 中氨气受热膨胀通过导管与水接触,即产生“喷泉”。
(3) 探究氨气具有还原性,氯气与氨气反应产生“白烟”的成分为氯化铵,氯元素化合价降低,则生成的“无色无味的气体”必为氨气的氧化产物,可推知为氮气。
(1) ace
(2) Ⅱ或Ⅲ 用热毛巾将烧瓶捂热(其他合理答案均可)
(3) $ 3Cl_{2}+8NH_{3}=6NH_{4}Cl+N_{2} $ 解析
(1) 在浓氨水中存在平衡:$ NH_{3}+H_{2}O \rightleftharpoons NH_{3}·H_{2}O \rightleftharpoons NH_{4}^{+}+OH^{-} $,向其中加入生石灰 [发生反应生成 $ Ca(OH)_{2} $ ] 或烧碱,都会使平衡左移,同时放出大量的热促进氨水的挥发。碱石灰的成分是烧碱和生石灰,原理同上述,都可快速制备氨气。
(2) 氨气极易溶于水,不溶于 $ CCl_{4} $,需选择防倒吸装置进行实验探究,因此需选择图 2 中的Ⅱ或Ⅲ。根据喷泉实验的原理,要使装置 D 发生喷泉现象。用热毛巾将烧瓶捂热,可使 D 中氨气受热膨胀通过导管与水接触,即产生“喷泉”。
(3) 探究氨气具有还原性,氯气与氨气反应产生“白烟”的成分为氯化铵,氯元素化合价降低,则生成的“无色无味的气体”必为氨气的氧化产物,可推知为氮气。
查看更多完整答案,请扫码查看


