2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 许多古迹是人类宝贵的文化遗产。下列古迹在传承过程中遇到的问题属于化学变化且未发生氧化还原反应的是(

B
)
答案:
B [石质阶梯被游客磨损,没有生成新的物质,是物理变化,A错误;石质雕像主要成分为碳酸盐,被酸雨腐蚀,生成新物质,属于化学变化,但不是氧化还原反应,B正确;铜质雕像逐渐变为绿色,铜单质变为碱式碳酸铜,生成新物质,属于氧化还原反应,C错误;在火灾中发生燃烧而坍塌,燃烧属于氧化还原反应,D错误。]
2. 下列反应不属于四种基本反应类型,但属于氧化还原反应的是(
A.$ Fe+CuSO_{4}\xlongequal{\;\;}FeSO_{4}+Cu $
B.$ 2HClO\xlongequal{\triangle \;}2HCl+O_{2}\uparrow $
C.$ 3CO+Fe_{2}O_{3}\xlongequal{高温\;}3CO_{2}+2Fe $
D.$ 2Na+Cl_{2}\xlongequal{\triangle \;}2NaCl $
C
)A.$ Fe+CuSO_{4}\xlongequal{\;\;}FeSO_{4}+Cu $
B.$ 2HClO\xlongequal{\triangle \;}2HCl+O_{2}\uparrow $
C.$ 3CO+Fe_{2}O_{3}\xlongequal{高温\;}3CO_{2}+2Fe $
D.$ 2Na+Cl_{2}\xlongequal{\triangle \;}2NaCl $
答案:
C [$3CO + Fe_{2}O_{3}\xlongequal{高温}3CO_{2} + 2Fe$不属于四种基本反应类型,C、Fe元素化合价改变,属于氧化还原反应,C项符合题意。]
3. (2024·云南师大附中高一月考)下列有关$ 3CO+Fe_{2}O_{3}\xlongequal{高温\;}2Fe+3CO_{2} $反应的说法正确的是(
A.$ CO $被还原
B.$ Fe_{2}O_{3} $被氧化
C.$ CO $得到电子
D.$ Fe_{2}O_{3} $发生还原反应
D
)A.$ CO $被还原
B.$ Fe_{2}O_{3} $被氧化
C.$ CO $得到电子
D.$ Fe_{2}O_{3} $发生还原反应
答案:
D [$3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}$中,$CO$转化为$CO_{2}$,其中C元素化合价升高,失去电子,被氧化,A、C错误;$Fe_{2}O_{3}$转化为Fe,其中Fe元素化合价降低,得到电子,被还原,所以$Fe_{2}O_{3}$发生还原反应,B错误,D正确。]
4. 一定条件下硝酸铵受热分解的化学方程式为$ 5NH_{4}NO_{3}\xlongequal{\triangle \;}2HNO_{3}+4N_{2}\uparrow +9H_{2}O $,在反应中被氧化与被还原的氮原子数之比为(
A.$ 5:3 $
B.$ 5:4 $
C.$ 1:1 $
D.$ 3:5 $
A
)A.$ 5:3 $
B.$ 5:4 $
C.$ 1:1 $
D.$ 3:5 $
答案:
A [设被氧化的氮原子数为$x$,被还原的氮原子数为$y$,根据得失电子守恒列式$x×|-3 - 0| = y×|+5 - 0|$,得$\frac{x}{y}=\frac{5}{3}$。]
5. 根据反应$ O_{2}+2H_{2}S\xlongequal{\;\;}2S\downarrow +2H_{2}O $,$ Na_{2}S+I_{2}\xlongequal{\;\;}2NaI+S\downarrow $,$ 4NaI+O_{2}+2H_{2}SO_{4}\xlongequal{\;\;}2I_{2}+2Na_{2}SO_{4}+2H_{2}O $判断下列物质的氧化性强弱,正确的是(
A.$ O_{2}>I_{2}>S $
B.$ H_{2}S>NaI>H_{2}O $
C.$ S>I_{2}>O_{2} $
D.$ H_{2}O>NaI>H_{2}S $
A
)A.$ O_{2}>I_{2}>S $
B.$ H_{2}S>NaI>H_{2}O $
C.$ S>I_{2}>O_{2} $
D.$ H_{2}O>NaI>H_{2}S $
答案:
A [在氧化还原反应中,氧化性:氧化剂>氧化产物,在反应$O_{2} + 2H_{2}S = 2S↓ + 2H_{2}O$中,氧化性:$O_{2} > S$;在反应$Na_{2}S + I_{2} = 2NaI + S↓$中,氧化性:$I_{2} > S$;在反应$4NaI + O_{2} + 2H_{2}SO_{4} = 2I_{2} + 2Na_{2}SO_{4} + 2H_{2}O$中,氧化性:$O_{2} > I_{2}$,因此,氧化性:$O_{2} > I_{2} > S$。]
6. $ Na_{2}S_{x} 在碱性溶液中可被 NaClO 氧化为 Na_{2}SO_{4} $,而$ NaClO 被还原为 NaCl $,若反应中$ Na_{2}S_{x} 与 NaClO 的物质的量之比为 1:16 $,则$ x $的值为(
A.2
B.3
C.4
D.5
D
)A.2
B.3
C.4
D.5
答案:
D [$Na_{2}\overset{-\frac{2}{x}}{S_{x}}→xNa_{2}\overset{+6}{SO_{4}}$,$Na\overset{+1}{ClO}→Na\overset{-1}{Cl}$,得关系式$1×[6 - (-\frac{2}{x})]·x = 16×2$,$x = 5$。]
7. 下列转化中,必须加入氧化剂才能实现的是(
① $ SO_{3}\rightarrow H_{2}SO_{4} $ ② $ CuO\rightarrow Cu $ ③ $ Fe^{2+}\rightarrow Fe^{3+} $ ④ $ KClO_{3}\rightarrow O_{2} $
A.①
B.②③④
C.③
D.③④
C
)① $ SO_{3}\rightarrow H_{2}SO_{4} $ ② $ CuO\rightarrow Cu $ ③ $ Fe^{2+}\rightarrow Fe^{3+} $ ④ $ KClO_{3}\rightarrow O_{2} $
A.①
B.②③④
C.③
D.③④
答案:
C [①$SO_{3}→H_{2}SO_{4}$的过程中S元素化合价没有变化,不是氧化还原反应;②$CuO→Cu$过程中Cu元素化合价降低,被还原,需加入还原剂才能实现;③$Fe^{2+}→Fe^{3+}$的过程中Fe元素化合价升高,被氧化,需加入氧化剂才能实现;④$KClO_{3}→O_{2}$的过程中O元素化合价升高,被氧化,但$KClO_{3}$分解过程无需加入氧化剂也能实现。]
8. 下列有关工业上冶炼钛的反应:$ TiCl_{4}+2Mg\xlongequal{高温\;}Ti+2MgCl_{2} $,说法正确的是(
A.反应过程中$ TiCl_{4} $失去电子
B.$ Mg $被氧化
C.$ TiCl_{4} $中氯元素被还原
D.每1个$ TiCl_{4} $被还原时转移2个电子
B
)A.反应过程中$ TiCl_{4} $失去电子
B.$ Mg $被氧化
C.$ TiCl_{4} $中氯元素被还原
D.每1个$ TiCl_{4} $被还原时转移2个电子
答案:
B [$TiCl_{4}$中Ti元素化合价由+4价降低为0价,$TiCl_{4}$得到电子,每1个$TiCl_{4}$被还原时转移4个电子,A、C、D错误;Mg元素化合价升高,被氧化,B正确。]
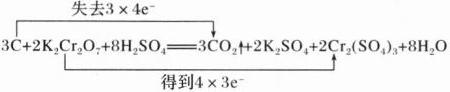
9. 储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为$ 3C+2K_{2}Cr_{2}O_{7}+8H_{2}SO_{4}\xlongequal{\;\;}3CO_{2}\uparrow +2K_{2}SO_{4}+2Cr_{2}(SO_{4})_{3}+8H_{2}O $。请回答下列问题:
(1)用双线桥法标明上述反应方程式中电子转移的方向和数目。
(2)上述反应中氧化剂是______,被氧化的元素是______(填元素符号)。
(3)$ H_{2}SO_{4} $在上述反应中表现出来的性质是______(填标号)。
A. 酸性
B. 氧化性
C. 氧化性和酸性
D. 还原性和酸性
(4)请配平下列离子方程式。
______$ Fe^{2+} $+______$ H^{+} $+______$ NO_{3}^{-} \xlongequal{\;\;} $______$ Fe^{3+} $+______$ N_{2}O\uparrow $+______$ H_{2}O $
(1)用双线桥法标明上述反应方程式中电子转移的方向和数目。
(2)上述反应中氧化剂是______,被氧化的元素是______(填元素符号)。
(3)$ H_{2}SO_{4} $在上述反应中表现出来的性质是______(填标号)。
A. 酸性
B. 氧化性
C. 氧化性和酸性
D. 还原性和酸性
(4)请配平下列离子方程式。
______$ Fe^{2+} $+______$ H^{+} $+______$ NO_{3}^{-} \xlongequal{\;\;} $______$ Fe^{3+} $+______$ N_{2}O\uparrow $+______$ H_{2}O $
答案:
(1)
(2)$K_{2}Cr_{2}O_{7}$ C
(3)A
(4)8 10 2 8 1 5
解析
(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,由化合价前后的变化分析可得答案;
(2)反应中铬元素的化合价降低,故氧化剂为$K_{2}Cr_{2}O_{7}$,碳元素的化合价升高,则碳元素被氧化;
(3)$H_{2}SO_{4}$在上述反应中生成盐和水,表现出酸性,$H_{2}SO_{4}$中各元素的化合价没有发生变化,既不体现氧化性也不体现还原性;
(4)离子反应中$Fe^{2+}$的化合价从+2升高到+3价,升高了1价,氮元素的化合价从+5价降低到+1价,降低了4价,两个氮原子的化合价共降低了8价,1和8的最小公倍数为8,故$Fe^{2+}$的系数为8,$NO_{3}^{-}$的系数为2,$Fe^{3+}$的系数为8,$N_{2}O$的系数为1,根据电荷守恒配平氢离子的系数为10,根据原子守恒配平水的系数为5,故离子反应方程式为$8Fe^{2+} + 10H^{+} + 2NO_{3}^{-} = 8Fe^{3+} + N_{2}O↑ + 5H_{2}O$。
(1)

(2)$K_{2}Cr_{2}O_{7}$ C
(3)A
(4)8 10 2 8 1 5
解析
(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,由化合价前后的变化分析可得答案;
(2)反应中铬元素的化合价降低,故氧化剂为$K_{2}Cr_{2}O_{7}$,碳元素的化合价升高,则碳元素被氧化;
(3)$H_{2}SO_{4}$在上述反应中生成盐和水,表现出酸性,$H_{2}SO_{4}$中各元素的化合价没有发生变化,既不体现氧化性也不体现还原性;
(4)离子反应中$Fe^{2+}$的化合价从+2升高到+3价,升高了1价,氮元素的化合价从+5价降低到+1价,降低了4价,两个氮原子的化合价共降低了8价,1和8的最小公倍数为8,故$Fe^{2+}$的系数为8,$NO_{3}^{-}$的系数为2,$Fe^{3+}$的系数为8,$N_{2}O$的系数为1,根据电荷守恒配平氢离子的系数为10,根据原子守恒配平水的系数为5,故离子反应方程式为$8Fe^{2+} + 10H^{+} + 2NO_{3}^{-} = 8Fe^{3+} + N_{2}O↑ + 5H_{2}O$。
10. (2024·珠海高一月考)$ ClO_{2} $是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得$ ClO_{2} $:$ 2KClO_{3}+H_{2}C_{2}O_{4}+H_{2}SO_{4}\xlongequal{\;\;}2ClO_{2}\uparrow +K_{2}SO_{4}+2CO_{2}\uparrow +2H_{2}O $。下列说法正确的是(
A.$ KClO_{3} $在反应中得到电子
B.$ KClO_{3} $被氧化
C.$ H_{2}C_{2}O_{4} $在反应中被还原
D.1个$ KClO_{3} $参加反应有2个电子转移
A
)A.$ KClO_{3} $在反应中得到电子
B.$ KClO_{3} $被氧化
C.$ H_{2}C_{2}O_{4} $在反应中被还原
D.1个$ KClO_{3} $参加反应有2个电子转移
答案:
A [由化学方程式可知,$KClO_{3}$中氯元素的化合价降低,得到电子,被还原,$H_{2}C_{2}O_{4}$中碳元素的化合价升高,被氧化,A正确,B、C错误;反应中1个氯酸钾参加反应有1个电子转移,D错误。]
查看更多完整答案,请扫码查看


