2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
11. 若将铜丝插入热浓硫酸中进行如图($ \text{a}~\text{d} $ 均为浸有相应溶液的棉花)所示的探究实验,下列分析正确的是(
A.$ {Cu} $ 与浓硫酸反应,只体现 $ {H_{2}SO_{4}} $ 的酸性
B.a 处变红,说明 $ {SO_{2}} $ 是酸性氧化物
C.b 或 c 处褪色,均说明 $ {SO_{2}} $ 具有漂白性
D.试管底部出现白色固体,说明反应中无 $ {H_{2}O} $ 生成
B
)A.$ {Cu} $ 与浓硫酸反应,只体现 $ {H_{2}SO_{4}} $ 的酸性
B.a 处变红,说明 $ {SO_{2}} $ 是酸性氧化物
C.b 或 c 处褪色,均说明 $ {SO_{2}} $ 具有漂白性
D.试管底部出现白色固体,说明反应中无 $ {H_{2}O} $ 生成
答案:
B [铜和浓硫酸反应过程中,生成 CuSO₄ 体现出浓硫酸的酸性,生成 SO₂ 体现出浓硫酸的强氧化性,故 A 错误;b 处品红溶液褪色,其原因是 SO₂ 具有漂白性,而 c 处酸性高锰酸钾溶液褪色,其原因是 SO₂ 和 KMnO₄ 发生氧化还原反应,SO₂ 体现出还原性,故 C 错误;实验过程中试管底部出现白色固体,根据元素守恒可知,其成分为无水 CuSO₄,而非蓝色的 CuSO₄·5H₂O,其原因是浓硫酸具有吸水性,将反应生成的 H₂O 吸收,故 D 错误。]
12. 某化学兴趣小组为探究铜与浓硫酸的反应,用如图所示装置进行有关实验。实验中甲同学将 $ a \ {g Cu} $ 片和 $ {12 mL 18 mol·L^{-1}} $ 浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的 $ {H_{2}SO_{4}} $ 和 $ {Cu} $ 剩余。
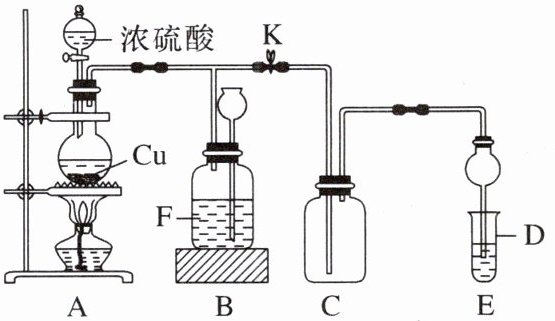
请回答下列问题:
(1)写出 $ {Cu} $ 与浓硫酸反应的化学方程式:
(2)装置 D 内盛品红溶液,当 C 中气体集满后,D 中有可能观察到的现象是
(3)装置 B 的作用是贮存多余的气体。当 D 处有明显现象后,关闭旋塞 K,移去酒精灯,但由于余热的作用,A 处仍有气体产生,此时 B 装置中的现象是
(4)F 中应放置的液体是
A.饱和 $ {Na_{2}SO_{3}} $ 溶液
B.酸性 $ {KMnO_{4}} $ 溶液
C.浓溴水
D.饱和 $ {NaHSO_{3}} $ 溶液
(5)烧瓶中有一定量的余酸,但未能使 $ {Cu} $ 完全溶解,你认为原因是
(6)下列足量药品能够用来证明反应结束后的烧瓶中确有余酸的是
A.Fe 粉
B.$ {BaCl_{2}} $ 溶液
C.Ag
D.$ {Na_{2}CO_{3}} $ 溶液
(7)甲同学向 A 中反应后的溶液中通入一种气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是

请回答下列问题:
(1)写出 $ {Cu} $ 与浓硫酸反应的化学方程式:
Cu + 2H₂SO₄(浓) $\xlongequal{\triangle}$ CuSO₄ + SO₂↑ + 2H₂O
。(2)装置 D 内盛品红溶液,当 C 中气体集满后,D 中有可能观察到的现象是
品红溶液褪色
。实验装置中有可能造成环境污染,试用最简单的方法解决(实验用品自选)将浸有 NaOH 溶液的棉花团塞在 D 试管口
。(3)装置 B 的作用是贮存多余的气体。当 D 处有明显现象后,关闭旋塞 K,移去酒精灯,但由于余热的作用,A 处仍有气体产生,此时 B 装置中的现象是
F 中液面下降,长颈漏斗中液面上升
。(4)F 中应放置的液体是
D
(填字母序号)。A.饱和 $ {Na_{2}SO_{3}} $ 溶液
B.酸性 $ {KMnO_{4}} $ 溶液
C.浓溴水
D.饱和 $ {NaHSO_{3}} $ 溶液
(5)烧瓶中有一定量的余酸,但未能使 $ {Cu} $ 完全溶解,你认为原因是
随着反应的进行,浓硫酸的浓度不断减小,稀硫酸与 Cu 不反应
。(6)下列足量药品能够用来证明反应结束后的烧瓶中确有余酸的是
AD
(填字母序号)。A.Fe 粉
B.$ {BaCl_{2}} $ 溶液
C.Ag
D.$ {Na_{2}CO_{3}} $ 溶液
(7)甲同学向 A 中反应后的溶液中通入一种气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是
氧气
(填名称),化学反应方程式是2Cu + 2H₂SO₄ + O₂ = 2CuSO₄ + 2H₂O
。
答案:
(1)Cu + 2H₂SO₄(浓) $\xlongequal{\triangle}$ CuSO₄ + SO₂↑ + 2H₂O
(2)品红溶液褪色 将浸有 NaOH 溶液的棉花团塞在 D 试管口
(3)F 中液面下降,长颈漏斗中液面上升
(4)D
(5)随着反应的进行,浓硫酸的浓度不断减小,稀硫酸与 Cu 不反应
(6)AD
(7)氧气(或臭氧) 2Cu + 2H₂SO₄ + O₂ = 2CuSO₄ + 2H₂O 解析 浓硫酸与 Cu 反应产生的 SO₂,可以使品红溶液褪色,SO₂ 可以用 NaOH 溶液吸收。B 装置的作用是贮存多余的气体,所以 F 中应盛放饱和 NaHSO₃ 溶液,以减少 SO₂ 的溶解。随着反应的进行,浓硫酸的浓度逐渐减小,稀硫酸与 Cu 不反应,所以虽然有一定量的余酸,但未能使 Cu 完全溶解。要证明反应后的圆底烧瓶中有剩余酸存在,即证明有 H⁺存在,不能使用 BaCl₂ 溶液和 Ag。要使 Cu 片全部溶解,应该加入氧化剂,通入的单质气体应为 O₂ 或 O₃,可不引入新的杂质。
(1)Cu + 2H₂SO₄(浓) $\xlongequal{\triangle}$ CuSO₄ + SO₂↑ + 2H₂O
(2)品红溶液褪色 将浸有 NaOH 溶液的棉花团塞在 D 试管口
(3)F 中液面下降,长颈漏斗中液面上升
(4)D
(5)随着反应的进行,浓硫酸的浓度不断减小,稀硫酸与 Cu 不反应
(6)AD
(7)氧气(或臭氧) 2Cu + 2H₂SO₄ + O₂ = 2CuSO₄ + 2H₂O 解析 浓硫酸与 Cu 反应产生的 SO₂,可以使品红溶液褪色,SO₂ 可以用 NaOH 溶液吸收。B 装置的作用是贮存多余的气体,所以 F 中应盛放饱和 NaHSO₃ 溶液,以减少 SO₂ 的溶解。随着反应的进行,浓硫酸的浓度逐渐减小,稀硫酸与 Cu 不反应,所以虽然有一定量的余酸,但未能使 Cu 完全溶解。要证明反应后的圆底烧瓶中有剩余酸存在,即证明有 H⁺存在,不能使用 BaCl₂ 溶液和 Ag。要使 Cu 片全部溶解,应该加入氧化剂,通入的单质气体应为 O₂ 或 O₃,可不引入新的杂质。
查看更多完整答案,请扫码查看


