2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 中华文化源远流长、博大精深。下列有关说法错误的是 (
A.《梦溪笔谈》记载“方家以磁石磨针锋,则能指南”,磁石的主要成分为$Fe_3O_4$
B.《中医药典》记载木耳具有“和血养营”(治疗贫血症)功效,黑木耳富含铁元素
C.《淮南万毕术》记载“曾青$(CuSO_4)$得铁,则化为铜,外化而内不化”,说明铁的还原性强于铜
D.《本草图经》“绿矾”项记载:“盖此矾色绿,味酸,烧之则赤……”,绿矾的化学式为$FeSO_4·7H_2O,FeSO_4·7H_2O$属于混合物
D
)A.《梦溪笔谈》记载“方家以磁石磨针锋,则能指南”,磁石的主要成分为$Fe_3O_4$
B.《中医药典》记载木耳具有“和血养营”(治疗贫血症)功效,黑木耳富含铁元素
C.《淮南万毕术》记载“曾青$(CuSO_4)$得铁,则化为铜,外化而内不化”,说明铁的还原性强于铜
D.《本草图经》“绿矾”项记载:“盖此矾色绿,味酸,烧之则赤……”,绿矾的化学式为$FeSO_4·7H_2O,FeSO_4·7H_2O$属于混合物
答案:
1. D [四氧化三铁俗称磁性氧化铁,磁石的主要成分为Fe₃O₄,A正确;曾青(CuSO₄)得铁,则化为铜,是铁和硫酸铜反应生成铜和硫酸亚铁,说明铁的还原性强于铜,C正确;FeSO₄·7H₂O属于纯净物,D错误。]
2. (2024·北京清华附中月考)下列有关铁的说法中正确的是 (
A.$FeCl_3$可通过化合反应或置换反应制得
B.铁和稀硫酸反应的离子方程式为$2Fe + 6H⁺ = 2Fe^3⁺ + 3H_2↑$
C.铁在纯氧中燃烧生成$Fe_3O_4$
D.常温下,Fe与$H_2O$不反应,但在空气中$O_2、$$H_2O$的共同作用下反应生成$Fe_3O_4$
C
)A.$FeCl_3$可通过化合反应或置换反应制得
B.铁和稀硫酸反应的离子方程式为$2Fe + 6H⁺ = 2Fe^3⁺ + 3H_2↑$
C.铁在纯氧中燃烧生成$Fe_3O_4$
D.常温下,Fe与$H_2O$不反应,但在空气中$O_2、$$H_2O$的共同作用下反应生成$Fe_3O_4$
答案:
2. C [Fe与Cl₂加热时发生化合反应生成FeCl₃,而Fe和盐酸反应生成FeCl₂,即不能通过置换反应制得,A错误;Fe和稀硫酸反应生成FeSO₄和H₂,其离子方程式为Fe + 2H⁺ = Fe²⁺ + H₂↑,B错误;Fe在纯氧中燃烧生成Fe₃O₄,C正确;常温下Fe与H₂O不反应,但在空气中O₂、H₂O的共同作用下反应生成铁锈(主要成分是Fe₂O₃·xH₂O),D错误。]
3. 下列除去杂质(括号中的物质为杂质)的方法正确的是 (
$A. Fe(OH)_3[Fe(OH)_2]$:灼烧
$B. FeCl_2$溶液$(FeCl_3)$:通入适量$Cl_2$
$C. FeCl_3$溶液$(CuCl_2)$:加入足量的Fe粉,过滤
$D. Cl_2(HCl)$:通过饱和食盐水洗气后干燥
D
)$A. Fe(OH)_3[Fe(OH)_2]$:灼烧
$B. FeCl_2$溶液$(FeCl_3)$:通入适量$Cl_2$
$C. FeCl_3$溶液$(CuCl_2)$:加入足量的Fe粉,过滤
$D. Cl_2(HCl)$:通过饱和食盐水洗气后干燥
答案:
3. D [Fe(OH)₃、Fe(OH)₂混合物在空气中灼烧得到铁的氧化物,故A错误;FeCl₂溶液(FeCl₃):通入适量Cl₂,氯化亚铁被氧化为氯化铁,故B错误;FeCl₃溶液(CuCl₂):加入足量的Fe粉,氯化铁和铁粉反应生成氯化亚铁,故C错误;Cl₂(HCl):HCl极易溶于水,可以被饱和食盐水吸收,故D正确。]
4. (2024·合肥高一期末)某学习小组进行了如图所示的实验,实验后组员之间的交流不合理的是 (
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰
B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁
C.丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
C
)A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰
B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁
C.丙同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应
D.丁同学认为用盐酸溶解固体生成物所得溶液有颜色
答案:
4. C [铁与水不反应,应该是水蒸气,丙同学的观点错误,故选C。]
5. 在$FeCl_3、$$CuCl_2、$$FeCl_2$的混合溶液中$,Fe^3⁺、$$Cu^2⁺、$$Fe^2⁺$的物质的量之比为3:2:1,现加入适量铁粉,使溶液中三种离子的物质的量之比变为1:2:4,则参加反应的铁粉与原溶液中$Fe^3⁺$的物质的量之比为 (
A.2:1
B.1:2
C.1:3
D.1:4
C
)A.2:1
B.1:2
C.1:3
D.1:4
答案:
5. C [根据三种离子物质的量的变化可知,Cu²⁺的物质的量并没有发生变化,说明没有参加反应,则反应的离子方程式为2Fe³⁺ + Fe = 3Fe²⁺,设溶液中Fe³⁺、Cu²⁺、Fe²⁺的物质的量分别为3mol、2mol、1mol,根据离子方程式可知Fe³⁺的物质的量减少2mol,则需消耗1mol铁粉,Fe²⁺的物质的量增加3mol,故参加反应的铁粉与原溶液中Fe³⁺的物质的量之比为1:3,C正确。]
6. (2024·合肥高一期末)在地壳中的金属含量仅次于铝的某元素“价—类”二维图如图所示,下列说法错误的是 (
A.a与水常温下几乎不发生反应,但在高温下可发生置换反应
B.b和c可分别与水发生反应生成e和d
C.e在潮湿的空气中容易转变为d
D.h的某种盐是具备净水和消毒双重功能的水处理剂
B
)A.a与水常温下几乎不发生反应,但在高温下可发生置换反应
B.b和c可分别与水发生反应生成e和d
C.e在潮湿的空气中容易转变为d
D.h的某种盐是具备净水和消毒双重功能的水处理剂
答案:
6. B [由题中信息可知,a为Fe、b为FeO、c为Fe₂O₃、d为Fe(OH)₃、e为Fe(OH)₂、f为亚铁盐、g为铁盐、h为高铁酸盐;FeO和Fe₂O₃均不溶于水,均不能直接与水反应生成相应的碱Fe(OH)₂和Fe(OH)₃,故选B。]
7. 如图所示装置,可以制取$Fe(OH)_2$且观察其在空气中被氧化时颜色的变化。下列说法错误的是 (
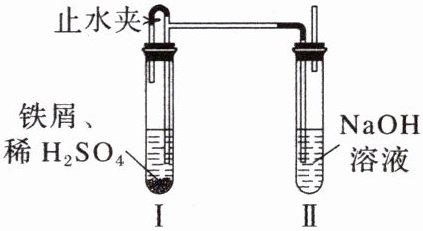
A.实验前,应先煮沸溶液除去溶解氧
B.装置Ⅰ可制取$FeSO_4$溶液并排尽装置内空气
C.关闭止水夹可观察到装置Ⅱ中溶液进入装置Ⅰ中
D.取下装置Ⅱ的橡皮塞可观察沉淀颜色变化
C
)
A.实验前,应先煮沸溶液除去溶解氧
B.装置Ⅰ可制取$FeSO_4$溶液并排尽装置内空气
C.关闭止水夹可观察到装置Ⅱ中溶液进入装置Ⅰ中
D.取下装置Ⅱ的橡皮塞可观察沉淀颜色变化
答案:
7. C [溶液中会溶解少量氧气,氢氧化亚铁易被氧气氧化,所以实验前,应先煮沸溶液除去溶解氧,故A正确;铁和稀H₂SO₄反应生成FeSO₄和H₂,H₂能排尽装置内的空气,故B正确;关闭止水夹可观察到装置Ⅰ中溶液进入装置Ⅱ中,故C错误;氢氧化亚铁具有还原性,能够被氧气氧化,所以取下装置Ⅱ的橡皮塞可观察沉淀颜色变化,故D正确。]
8. 工业用$FeCl_3$溶液刻蚀电路板的废液中主要含有$Cu^2⁺、$$Fe^2⁺、$$Fe^3⁺、$Cl⁻,实验室从废液中回收某些物质的流程如下:
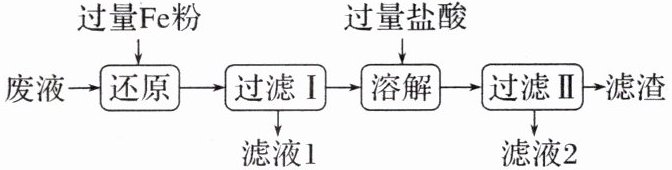
下列说法正确的是 (
A.还原过程中,溶液中可能存在的阳离子有$Fe^2⁺、$$Fe^3⁺$
B.溶解过程中反应的离子方程式:$2Fe + 6H⁺ = 2Fe^3⁺ + 3H_2↑$
C.滤液1、滤液2合并后通入过量的$Cl_2,$重新获得$FeCl_3$溶液
D.滤渣的成分为Fe和Cu

下列说法正确的是 (
C
)A.还原过程中,溶液中可能存在的阳离子有$Fe^2⁺、$$Fe^3⁺$
B.溶解过程中反应的离子方程式:$2Fe + 6H⁺ = 2Fe^3⁺ + 3H_2↑$
C.滤液1、滤液2合并后通入过量的$Cl_2,$重新获得$FeCl_3$溶液
D.滤渣的成分为Fe和Cu
答案:
8. C [还原过程中铁与铁离子反应生成亚铁离子,铁与铜离子反应生成亚铁离子和铜,溶液中不可能存在铁离子,A错误;溶解过程中,铁与盐酸反应生成氯化亚铁和氢气,离子方程式为Fe + 2H⁺ = Fe²⁺ + H₂↑,B错误;滤液1和滤液2的主要成分为氯化亚铁,两者合并后通入氯气,氯气与氯化亚铁反应生成氯化铁,可重新获得氯化铁溶液,C正确;滤渣为铜,D错误。]
查看更多完整答案,请扫码查看


