2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 下列有关物质电离方程式的书写正确的是 (
$A. Al_2(SO_4)_3 = 2Al^3⁺ + 3SO_4^2⁻$
$B. AlCl_3 = Al^3⁺ + Cl_3⁻$
$C. Mg(NO_3)_2 = Mg⁺^2 + 2NO_3⁻$
$D. KMnO_4 = K⁺ + Mn^7⁺ + 4O^2⁻$
A
)$A. Al_2(SO_4)_3 = 2Al^3⁺ + 3SO_4^2⁻$
$B. AlCl_3 = Al^3⁺ + Cl_3⁻$
$C. Mg(NO_3)_2 = Mg⁺^2 + 2NO_3⁻$
$D. KMnO_4 = K⁺ + Mn^7⁺ + 4O^2⁻$
答案:
A [$ AlCl_{3} $ 的电离方程式应为 $ AlCl_{3} = Al^{3+} + 3Cl^{-} $,B 错误;$ Mg(NO_{3})_{2} $ 的电离方程式为 $ Mg(NO_{3})_{2} = Mg^{2+} + 2NO_{3}^{-} $,C 错误;$ KMnO_{4} $ 的电离方程式应为 $ KMnO_{4} = K^{+} + MnO_{4}^{-} $,D 错误。]
2. 离子方程式$CO_3^2⁻ + 2H⁺ = CO_2↑ + H_2O$中$,CO_3^2⁻$代表的物质可以是 (
$A. CaCO_3$
$B. NH_4HCO_3$
$C. CuCO_3$
$D. K_2CO_3$
D
)$A. CaCO_3$
$B. NH_4HCO_3$
$C. CuCO_3$
$D. K_2CO_3$
答案:
D [A. $ CaCO_{3} $ 不能拆成离子的形式,A 错误;B. $ NH_{4}HCO_{3} $ 只能拆成 $ NH_{4}^{+} $ 和 $ HCO_{3}^{-} $,不能拆成 $ CO_{3}^{2-} $,B 错误;C. $ CuCO_{3} $ 难溶,不能拆成离子的形式,C 错误;D. $ K_{2}CO_{3} $ 在水溶液中完全电离生成钾离子和碳酸根离子,在离子方程式中可用 $ CO_{3}^{2-} $ 表示,D 正确。]
3. 下列化学反应的离子方程式正确的是 (
A.盐酸和石灰石制$CO_2$:$CO_3^2⁻ + 2H⁺ = H_2O + CO_2↑$
B.氢氧化铜与稀盐酸反应:$Cu(OH)_2 + 2H⁺ = Cu^2⁺ + 2H_2O$
C.铜片插入硝酸银溶液中:$Cu + Ag⁺ = Cu^2⁺ + Ag$
D.往澄清石灰水中通入二氧化碳气体:$CO_2 + Ca(OH)_2 = CaCO_3↓ + H_2O$
B
)A.盐酸和石灰石制$CO_2$:$CO_3^2⁻ + 2H⁺ = H_2O + CO_2↑$
B.氢氧化铜与稀盐酸反应:$Cu(OH)_2 + 2H⁺ = Cu^2⁺ + 2H_2O$
C.铜片插入硝酸银溶液中:$Cu + Ag⁺ = Cu^2⁺ + Ag$
D.往澄清石灰水中通入二氧化碳气体:$CO_2 + Ca(OH)_2 = CaCO_3↓ + H_2O$
答案:
B [石灰石为固体,离子方程式中不能拆成离子,正确的离子方程式为 $ CaCO_{3} + 2H^{+} = Ca^{2+} + H_{2}O + CO_{2} \uparrow $,A 错误;氢氧化铜为固体,离子方程式中不能拆成离子,离子方程式为 $ Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O $,B 正确;离子方程式中电荷不守恒,正确的离子方程式为 $ Cu + 2Ag^{+} = Cu^{2+} + 2Ag $,C 错误;澄清石灰水作为反应物时,$ Ca(OH)_{2} $ 拆成离子,正确的离子方程式为 $ CO_{2} + Ca^{2+} + 2OH^{-} = CaCO_{3} \downarrow + H_{2}O $,D 错误。]
4. 下列各组中反应Ⅰ和反应Ⅱ能用同一离子方程式表示的是 (
|选项|反应Ⅰ|反应Ⅱ|
|A|$Cu(OH)_2$与稀盐酸|NaOH与稀硫酸|
|B|$Na_2CO_3$溶液与稀盐酸|$BaCO_3$与稀盐酸|
|C|$BaCl_2$溶液与$NaHSO_4$溶液|$Ba(OH)_2$溶液与$K_2SO_4$溶液|
|D|$CaCO_3$与稀硝酸|$CaCO_3$与稀醋酸|
C
)|选项|反应Ⅰ|反应Ⅱ|
|A|$Cu(OH)_2$与稀盐酸|NaOH与稀硫酸|
|B|$Na_2CO_3$溶液与稀盐酸|$BaCO_3$与稀盐酸|
|C|$BaCl_2$溶液与$NaHSO_4$溶液|$Ba(OH)_2$溶液与$K_2SO_4$溶液|
|D|$CaCO_3$与稀硝酸|$CaCO_3$与稀醋酸|
答案:
C [A 项,$ Cu(OH)_{2} $ 与 HCl 反应对应离子方程式为 $ Cu(OH)_{2} + 2H^{+} = Cu^{2+} + 2H_{2}O $,NaOH 与 $ H_{2}SO_{4} $ 反应对应离子方程式为 $ OH^{-} + H^{+} = H_{2}O $;B 项,$ Na_{2}CO_{3} $ 与 HCl 反应对应离子方程式为 $ CO_{3}^{2-} + 2H^{+} = CO_{2} \uparrow + H_{2}O $,碳酸钡与稀盐酸反应对应离子方程式为 $ BaCO_{3} + 2H^{+} = Ba^{2+} + H_{2}O + CO_{2} \uparrow $;C 项,$ BaCl_{2} $ 与 $ NaHSO_{4} $ 反应对应离子方程式为 $ SO_{4}^{2-} + Ba^{2+} = BaSO_{4} \downarrow $,$ Ba(OH)_{2} $ 与 $ K_{2}SO_{4} $ 反应对应离子方程式为 $ Ba^{2+} + SO_{4}^{2-} = BaSO_{4} \downarrow $;D 项,碳酸钙与稀硝酸反应对应离子方程式为 $ CaCO_{3} + 2H^{+} = Ca^{2+} + H_{2}O + CO_{2} \uparrow $,碳酸钙与稀醋酸反应对应离子方程式为 $ CaCO_{3} + 2CH_{3}COOH = Ca^{2+} + 2CH_{3}COO^{-} + H_{2}O + CO_{2} \uparrow $。]
5. 欲配制下列四种无色透明的溶液,其中能配制成功的是 (
A.$NH_4⁺、$$NO_3⁻、$Cl⁻、$Al^3⁺$
B.$Ca^2⁺、$OH⁻、Na⁺、$HCO_3⁻$
C.$ MnO_4⁻、$K⁺、$SO_4^2⁻、$Na⁺
D.H⁺、$Fe^2⁺、$Cl⁻、$NO_3⁻$
A
)A.$NH_4⁺、$$NO_3⁻、$Cl⁻、$Al^3⁺$
B.$Ca^2⁺、$OH⁻、Na⁺、$HCO_3⁻$
C.$ MnO_4⁻、$K⁺、$SO_4^2⁻、$Na⁺
D.H⁺、$Fe^2⁺、$Cl⁻、$NO_3⁻$
答案:
A [四种离子都没有颜色且不发生反应,可以大量共存,A 正确;$ OH^{-} $ 与 $ HCO_{3}^{-} $ 反应生成 $ H_{2}O $ 和 $ CO_{3}^{2-} $,不能大量共存,B 错误;$ MnO_{4}^{-} $ 显紫红色,与题意不符,C 错误;$ Fe^{2+} $ 显浅绿色,与题意不符,D 错误。]
6. (2024·深圳市光明区高级中学高一期中)除去粗盐中的杂质$CaCl_2、$$MgCl_2$和$Na_2SO_4。$过程如下:

下列说法不正确的是 (
A.试剂①可能是$Na_2CO_3$溶液
B.滤液中加盐酸是为了除去多余的$CO_3^2⁻$和OH⁻
C.除$Ca^2⁺$的离子方程式为$Ca^2⁺ + CO_3^2⁻ = CaCO_3↓$
D.检验$SO_4^2⁻$是否除净的操作:取少量滤液,加稀盐酸酸化后,再加$BaCl_2$溶液

下列说法不正确的是 (
A
)A.试剂①可能是$Na_2CO_3$溶液
B.滤液中加盐酸是为了除去多余的$CO_3^2⁻$和OH⁻
C.除$Ca^2⁺$的离子方程式为$Ca^2⁺ + CO_3^2⁻ = CaCO_3↓$
D.检验$SO_4^2⁻$是否除净的操作:取少量滤液,加稀盐酸酸化后,再加$BaCl_2$溶液
答案:
A [粗盐除杂常用氯化钡除去硫酸根离子,碳酸钠除去钙离子和多余的钡离子,氢氧化钠除去多余的镁离子。试剂①不能是 $ Na_{2}CO_{3} $ 溶液,碳酸钠溶液应该在氯化钡溶液之后加入,故 A 错误;由于加入过量的碳酸钠和氢氧化钠溶液,因此滤液有多余的 $ CO_{3}^{2-} $ 和 $ OH^{-} $,加盐酸主要是除去多余的 $ CO_{3}^{2-} $ 和 $ OH^{-} $,故 B 正确;加入碳酸钠除去钙离子,因此除 $ Ca^{2+} $ 的离子方程式为 $ Ca^{2+} + CO_{3}^{2-} = CaCO_{3} \downarrow $,故 C 正确;检验 $ SO_{4}^{2-} $ 是否除净的操作:取少量滤液,加稀盐酸酸化后,无现象,再加 $ BaCl_{2} $ 溶液,若有白色沉淀生成,说明含有硫酸根离子,$ SO_{4}^{2-} $ 未除净,故 D 正确。]
7. 下列实验操作与离子方程式对应的是 (
|选项|实验操作|离子方程式|
|A|将过量的锌粉加入$FeCl_3$溶液中|$Zn + 2Fe^3⁺ = Zn^2⁺ + 2Fe^2⁺$|
|B|向澄清石灰水中通入少量$CO_2$|$CO_2 + OH⁻ = HCO_3⁻$|
|C|铁与浓盐酸反应|$6H⁺ + 2Fe = 2Fe^3⁺ + 3H_2↑$|
|D|向$Ba(OH)_2$溶液中加入$NaHSO_4$溶液至完全中和|$Ba^2⁺ + 2OH⁻ + 2H⁺ + SO_4^2⁻ = BaSO_4↓ + 2H_2O$|
D
)|选项|实验操作|离子方程式|
|A|将过量的锌粉加入$FeCl_3$溶液中|$Zn + 2Fe^3⁺ = Zn^2⁺ + 2Fe^2⁺$|
|B|向澄清石灰水中通入少量$CO_2$|$CO_2 + OH⁻ = HCO_3⁻$|
|C|铁与浓盐酸反应|$6H⁺ + 2Fe = 2Fe^3⁺ + 3H_2↑$|
|D|向$Ba(OH)_2$溶液中加入$NaHSO_4$溶液至完全中和|$Ba^2⁺ + 2OH⁻ + 2H⁺ + SO_4^2⁻ = BaSO_4↓ + 2H_2O$|
答案:
D [将过量的锌粉加入 $ FeCl_{3} $ 溶液中会置换出 Fe,故该反应的离子方程式为 $ 3Zn + 2Fe^{3+} = 3Zn^{2+} + 2Fe $,A 错误;向澄清石灰水中通入少量 $ CO_{2} $ 生成碳酸钙和水,故该反应的离子方程式为 $ Ca^{2+} + 2OH^{-} + CO_{2} = CaCO_{3} \downarrow + H_{2}O $,B 错误;铁与浓盐酸反应生成氯化亚铁和氢气,故该反应的离子方程式为 $ 2H^{+} + Fe = Fe^{2+} + H_{2} \uparrow $,C 错误。]
8. 某无色透明的溶液中含有$Cu^2⁺、$$Mg^2⁺、$$Al^3⁺、$$Ba^2⁺、$H⁺、Ag⁺、$SO_4^2⁻、$$HCO_3⁻、$OH⁻、$NO_3⁻$中的三种离子,若向其中加入石蕊溶液,溶液显蓝色,且滴入盐酸无气泡产生,则原溶液中可能存在的离子是 (
A.$Ba^2⁺、$OH⁻、$NO_3⁻$
B.Ag⁺、$HCO_3⁻、$$NO_3⁻$
C.$Mg^2⁺、$$Al^3⁺、$$SO_4^2⁻$
D.$Mg^2⁺、$$SO_4^2⁻、$OH⁻
A
)A.$Ba^2⁺、$OH⁻、$NO_3⁻$
B.Ag⁺、$HCO_3⁻、$$NO_3⁻$
C.$Mg^2⁺、$$Al^3⁺、$$SO_4^2⁻$
D.$Mg^2⁺、$$SO_4^2⁻、$OH⁻
答案:
A [无色透明的溶液中不会存在 $ Cu^{2+} $;向其中加入石蕊溶液,溶液显蓝色,说明该溶液为碱性溶液,且滴入盐酸后,无气泡产生,则溶液中存在大量 $ OH^{-} $,不含 $ HCO_{3}^{-} $;因为阳离子 $ Mg^{2+} $、$ Ag^{+} $、$ Al^{3+} $、$ H^{+} $ 都与 $ OH^{-} $ 反应,则溶液中一定存在 $ Ba^{2+} $;又 $ SO_{4}^{2-} $ 与 $ Ba^{2+} $ 反应,则溶液中一定不存在 $ SO_{4}^{2-} $;因为有三种离子存在,则一定存在 $ NO_{3}^{-} $。]
9. 某同学称取一定质量的$MgCl_2$固体配成溶液,在该溶液中加入一定量的盐酸,然后向此混合溶液中逐滴加入NaOH溶液,如图甲。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。请回答下列问题:
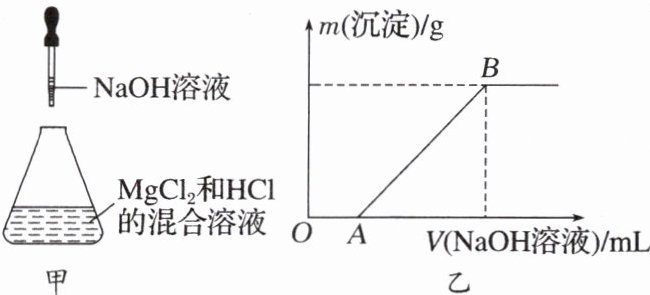
(1)溶解$MgCl_2$固体所用的玻璃仪器有
a. 容量瓶 b. 烧杯 c. 量筒 d. 玻璃棒
(2)OA段反应的离子方程式为
(3)AB段反应的离子方程式为
(4)在B点对应的溶液中滴加$AgNO_3$溶液,观察到的现象是

(1)溶解$MgCl_2$固体所用的玻璃仪器有
bd
(填字母)。a. 容量瓶 b. 烧杯 c. 量筒 d. 玻璃棒
(2)OA段反应的离子方程式为
$ H^{+} + OH^{-} = H_{2}O $
。(3)AB段反应的离子方程式为
$ Mg^{2+} + 2OH^{-} = Mg(OH)_{2} \downarrow $
。(4)在B点对应的溶液中滴加$AgNO_3$溶液,观察到的现象是
有白色沉淀生成
,反应的离子方程式为$ Ag^{+} + Cl^{-} = AgCl \downarrow $
。
答案:
9.
(1) bd
(2) $ H^{+} + OH^{-} = H_{2}O $
(3) $ Mg^{2+} + 2OH^{-} = Mg(OH)_{2} \downarrow $
(4) 有白色沉淀生成 $ Ag^{+} + Cl^{-} = AgCl \downarrow $
(1) bd
(2) $ H^{+} + OH^{-} = H_{2}O $
(3) $ Mg^{2+} + 2OH^{-} = Mg(OH)_{2} \downarrow $
(4) 有白色沉淀生成 $ Ag^{+} + Cl^{-} = AgCl \downarrow $
查看更多完整答案,请扫码查看


