2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
12.2022 年 3 月 23 日,“天宫课堂”第二课中王亚平老师用结构为 的物质制作出“冰球”,其中 X、Y、Z、M 是原子序数依次增大的短周期主族元素,M 的焰色试验中火焰呈黄色。下列说法错误的是 (
的物质制作出“冰球”,其中 X、Y、Z、M 是原子序数依次增大的短周期主族元素,M 的焰色试验中火焰呈黄色。下列说法错误的是 (
A.该物质中含有离子键、极性共价键和非极性共价键
B.最简单氢化物的稳定性:Z<Y
C.Z 的两种常见同素异形体均有氧化性
D.X、Y、Z、M 形成的无机盐的水溶液显碱性
 的物质制作出“冰球”,其中 X、Y、Z、M 是原子序数依次增大的短周期主族元素,M 的焰色试验中火焰呈黄色。下列说法错误的是 (
的物质制作出“冰球”,其中 X、Y、Z、M 是原子序数依次增大的短周期主族元素,M 的焰色试验中火焰呈黄色。下列说法错误的是 (B
)A.该物质中含有离子键、极性共价键和非极性共价键
B.最简单氢化物的稳定性:Z<Y
C.Z 的两种常见同素异形体均有氧化性
D.X、Y、Z、M 形成的无机盐的水溶液显碱性
答案:
12. B [根据M的焰色试验中火焰呈黄色推测M元素为Na元素,根据Y元素形成4个共价键推测Y元素为C元素,X元素形成1个共价键且原子序数最小推测X元素为H元素,Z元素形成2个共价键且原子序数大于Y小于M推测Z元素为O元素,据此分析。A.该物质由阴阳离子构成,其中含有离子键,也存在X - Y等极性共价键和Y - Y非极性共价键,故A正确;B.据分析Z和Y最简单氢化物分别为H₂O和CH₄,稳定性:Z > Y,故B错误;C.Z元素为O元素,Z的两种常见同素异形体分别为氧气和臭氧,均有氧化性,故C正确;D.X、Y、Z、M形成的无机盐是NaHCO₃,水溶液显碱性,故D正确。]
13. 如图为元素周期表的一部分,请参照①~⑧在表中的位置,回答下列问题:

(1)元素②在元素周期表中的位置是
(2)元素①~⑧中,化学性质最稳定的是
(3)元素①~⑦形成的简单离子中,离子半径最大的是
(4)请从原子结构的角度解释元素③的非金属性比⑥强的原因:
(5)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示:
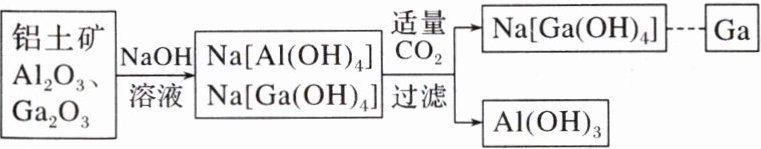
氧化镓与 NaOH 溶液反应的化学方程式为

(1)元素②在元素周期表中的位置是
第二周期第ⅣA族
。(2)元素①~⑧中,化学性质最稳定的是
He
(填元素符号,下同),最易与$ H_2 $生成气态氢化物的是F
,最高价氧化物对应水化物酸性最强的是HClO₄
(填化学式)。(3)元素①~⑦形成的简单离子中,离子半径最大的是
S²⁻
(填离子符号)。(4)请从原子结构的角度解释元素③的非金属性比⑥强的原因:
氧和硫都是第ⅥA族元素,最外层电子数均是6,但是氧原子的半径小,原子核吸引电子能力强,得电子能力强,故非金属性强
。(5)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示:

氧化镓与 NaOH 溶液反应的化学方程式为
Ga₂O₃ + 2NaOH + 3H₂O = 2Na[Ga(OH)₄]
。
答案:
13.
(1)第二周期第ⅣA族
(2)He F HClO₄
(3)S²⁻
(4)氧和硫都是第ⅥA族元素,最外层电子数均是6,但是氧原子的半径小,原子核吸引电子能力强,得电子能力强,故非金属性强
(5)Ga₂O₃ + 2NaOH + 3H₂O = 2Na[Ga(OH)₄]
解析
(1)元素②为C,位于第二周期第ⅣA族。
(2)元素①~⑧中,化学性质最稳定的是稀有气体He,F的非金属性最强,故最易与H₂生成气态氢化物的是F;Cl的最高价氧化物对应水化物的酸性最强,最高价氧化物对应的水化物为高氯酸 (HClO₄)。
(3)元素①~⑦形成的简单离子中,电子层数越多,离子半径越大,电子层数相同时,核电荷数越多半径越小,离子半径最大的是S²⁻。
(5)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物,氧化镓与NaOH反应生成四羟基合镓酸钠,化学方程式为Ga₂O₃ + 2NaOH + 3H₂O = 2Na[Ga(OH)₄]。
(1)第二周期第ⅣA族
(2)He F HClO₄
(3)S²⁻
(4)氧和硫都是第ⅥA族元素,最外层电子数均是6,但是氧原子的半径小,原子核吸引电子能力强,得电子能力强,故非金属性强
(5)Ga₂O₃ + 2NaOH + 3H₂O = 2Na[Ga(OH)₄]
解析
(1)元素②为C,位于第二周期第ⅣA族。
(2)元素①~⑧中,化学性质最稳定的是稀有气体He,F的非金属性最强,故最易与H₂生成气态氢化物的是F;Cl的最高价氧化物对应水化物的酸性最强,最高价氧化物对应的水化物为高氯酸 (HClO₄)。
(3)元素①~⑦形成的简单离子中,电子层数越多,离子半径越大,电子层数相同时,核电荷数越多半径越小,离子半径最大的是S²⁻。
(5)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物,氧化镓与NaOH反应生成四羟基合镓酸钠,化学方程式为Ga₂O₃ + 2NaOH + 3H₂O = 2Na[Ga(OH)₄]。
14. 为探究同主族元素非金属性的递变规律,某研究性学习小组的同学设计了如图所示的实验装置,其中 A 装置内可生成$ Cl_2。$
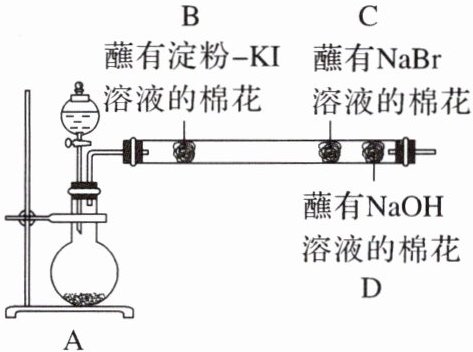
请回答下列问题:
(1)甲同学的部分实验记录如下:B 处棉花变成蓝色;C 处棉花变成橙红色。甲同学由此现象得出的结论是同主族元素从上到下非金属性减弱。
①B 处发生反应的化学方程式为
②甲同学的结论
(2)乙同学认为应将甲同学实验中 B、C 两处的棉花调换位置,用氯气先置换出溴,然后溴再与 KI 接触,以判断$ Br_2 $与 KI 能否发生反应。该设想
(3)丙同学在甲同学的实验结束后,取出 C 处的棉花,将其与另一个蘸有淀粉-KI 溶液的棉花(E)接触,发现 E 慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此观点吗?

请回答下列问题:
(1)甲同学的部分实验记录如下:B 处棉花变成蓝色;C 处棉花变成橙红色。甲同学由此现象得出的结论是同主族元素从上到下非金属性减弱。
①B 处发生反应的化学方程式为
Cl₂ + 2KI = I₂ + 2KCl
。②甲同学的结论
不正确
(填“正确”或“不正确”),理由是该实验没有验证Br₂能否与KI反应,无法确定溴与碘元素的非金属性强弱
。(2)乙同学认为应将甲同学实验中 B、C 两处的棉花调换位置,用氯气先置换出溴,然后溴再与 KI 接触,以判断$ Br_2 $与 KI 能否发生反应。该设想
不合理
(填“合理”或“不合理”),原因是氯气不可能被NaBr消耗完,它会与溴一起到达C处
。(3)丙同学在甲同学的实验结束后,取出 C 处的棉花,将其与另一个蘸有淀粉-KI 溶液的棉花(E)接触,发现 E 慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此观点吗?
同意
(填“同意”或“不同意”),理由是甲、丙的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强
。
答案:
14.
(1)①Cl₂ + 2KI = I₂ + 2KCl ②不正确 该实验没有验证Br₂能否与KI反应,无法确定溴与碘元素的非金属性强弱
(2)不合理 氯气不可能被NaBr消耗完,它会与溴一起到达C处
(3)同意 甲、丙的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强
解析
(1)B处为氯气与碘化钾生成单质碘的反应,反应的化学方程式为Cl₂ + 2KI = I₂ + 2KCl;该实验只能验证Cl₂与I₂、Br₂氧化性的强弱,因没有验证Br₂能否与KI反应,无法确定溴与碘元素的非金属性强弱。
(2)氯气不可能被NaBr消耗完,它会与溴一起到达C处,因此无法判断溴一定能置换出碘,所以不合理。
(3)甲、丙同学的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强,所以该观点正确。
(1)①Cl₂ + 2KI = I₂ + 2KCl ②不正确 该实验没有验证Br₂能否与KI反应,无法确定溴与碘元素的非金属性强弱
(2)不合理 氯气不可能被NaBr消耗完,它会与溴一起到达C处
(3)同意 甲、丙的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强
解析
(1)B处为氯气与碘化钾生成单质碘的反应,反应的化学方程式为Cl₂ + 2KI = I₂ + 2KCl;该实验只能验证Cl₂与I₂、Br₂氧化性的强弱,因没有验证Br₂能否与KI反应,无法确定溴与碘元素的非金属性强弱。
(2)氯气不可能被NaBr消耗完,它会与溴一起到达C处,因此无法判断溴一定能置换出碘,所以不合理。
(3)甲、丙同学的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强,所以该观点正确。
查看更多完整答案,请扫码查看


