2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
5. 下列关于元素周期表知识的说法正确的是(
A.元素周期表的第一列都是碱金属元素
B.共有 18 个族,ⅢB 族含元素种类最多
C.在金属元素与非金属元素的交界处寻找半导体材料
D.某元素原子最外电子层上只有两个电子,该元素一定是ⅡA 族元素
C
)A.元素周期表的第一列都是碱金属元素
B.共有 18 个族,ⅢB 族含元素种类最多
C.在金属元素与非金属元素的交界处寻找半导体材料
D.某元素原子最外电子层上只有两个电子,该元素一定是ⅡA 族元素
答案:
C [A.元素周期表中第一列的氢元素不是碱金属元素,A 错误;B.元素周期表有 7 个主族,7 个副族,1 个 0 族和一个Ⅷ族,共 16 个族,B 错误;C.金属元素和非金属元素交界处的元素具有金属性、非金属性,可用作半导体材料,C 正确;D.$He$元素最外层电子数为 2,但是其为 0 族元素,D 错误。]
6. 若原子序数为 x 的某元素位于第ⅡB 族,那么原子序数为$x + 1$的元素位于(
A.第ⅢB 族
B.第ⅢA 族
C.第ⅠB 族
D.第ⅠA 族
B
)A.第ⅢB 族
B.第ⅢA 族
C.第ⅠB 族
D.第ⅠA 族
答案:
B [元素周期表中与第ⅡB 族之后相邻的族为第ⅢA 族,则原子序数为$x + 1$的元素位于第ⅢA 族,只有 B 项符合题意。]
7. 下列叙述正确的是(
A.Na 在空气中燃烧会生成$Na_{2}O_{2}$,故 Li 在空气中燃烧也会生成$Li_{2}O_{2}$
B.碱金属元素是指第ⅠA 族的所有元素
C.在熔融状态下,钠可以从$MgCl_{2}$中置换出镁
D.Li、Na、K 都可以保存在煤油中
C
)A.Na 在空气中燃烧会生成$Na_{2}O_{2}$,故 Li 在空气中燃烧也会生成$Li_{2}O_{2}$
B.碱金属元素是指第ⅠA 族的所有元素
C.在熔融状态下,钠可以从$MgCl_{2}$中置换出镁
D.Li、Na、K 都可以保存在煤油中
答案:
C [$Li$在空气中燃烧只生成$Li_{2}O$,故 A 错误;碱金属元素是指第ⅠA 族除氢元素外的金属元素,故 B 错误;钠比镁金属性强,能在熔融状态下置换出氯化镁中的镁单质,故 C 正确;$Li$的密度比煤油小,不能保存在煤油中,故 D 错误。]
8. (2024·杭州高一期末)已知砹$(_{85}At)$位于第六周期第ⅦA 族,关于砹$(_{85}At)$及其化合物说法正确的是(
A.稳定性:$HAt>HCl$
B.氧化性:$At_{2}>I_{2}$
C.还原性:$HAt>HCl$
D.$At_{2}$是白色无毒晶体
C
)A.稳定性:$HAt>HCl$
B.氧化性:$At_{2}>I_{2}$
C.还原性:$HAt>HCl$
D.$At_{2}$是白色无毒晶体
答案:
C [卤族元素由上而下,非金属性逐渐变弱,则稳定性:$HAt\lt HCl$,A 错误;单质氧化性:$At_{2}\lt I_{2}$,B 错误;氢化物还原性:$HAt\gt HCl$,C 正确;卤族元素由上而下,单质颜色加深,$At_{2}$不是白色晶体,D 错误。]
9. (2024·上海高一上期中)一种用于“点击化学”的新化合物由 W、X、Y、Z 四种前 20 号元素组成,且原子序数依次增大。X 原子的最外层电子数是次外层电子数的 3 倍,X、Z 原子最外层电子数相同;Y 元素的负离子核外电子排布和氖原子相同,Y 原子的最外层电子数与 W 原子的核外电子总数相等。
(1)Y 原子的结构示意图为____,W 离子的电子式是____。
(2)比较微粒半径大小(选 A 表示“>”、B 表示“=”或 C 表示“<”):
X 原子____Z 原子,X 离子____Y 离子。
(3)含 W 元素的$10e^{-}$离子有____(写出 1 种化学式,下同),除含 X 元素外,还含一种元素的$18e^{-}$微粒有____。
(1)Y 原子的结构示意图为____,W 离子的电子式是____。
(2)比较微粒半径大小(选 A 表示“>”、B 表示“=”或 C 表示“<”):
X 原子____Z 原子,X 离子____Y 离子。
(3)含 W 元素的$10e^{-}$离子有____(写出 1 种化学式,下同),除含 X 元素外,还含一种元素的$18e^{-}$微粒有____。
答案:
(1) $[\ddot{N}:]^{3 - }$
$[\ddot{N}:]^{3 - }$
(2)C A
(3)$NH_{4}^{+}$或$NH_{2}^{-}$ $H_{2}O_{2}$ 解析 $W$、$X$、$Y$、$Z$四种前 20 号元素,且原子序数依次增大。$X$原子的最外层电子数是次外层电子数的 3 倍,则$X$为氧元素,$X$、$Z$原子最外层电子数相同,则$Z$为硫元素,$Y$元素的负离子核外电子排布和氖原子相同,且$Y$原子序数大于氧元素,$Y$为氟元素。$Y$原子的最外层电子数与$W$原子的核外电子总数相等,则$W$为氮元素。综上所述,$W$、$X$、$Y$、$Z$分别为$N$、$O$、$F$、$S$。
(1)$Y$为$F$,其原子的结构示意图为 ,$W$是$N$,其离子的电子式是$[\ddot{N}:]^{3 - }$;
,$W$是$N$,其离子的电子式是$[\ddot{N}:]^{3 - }$;
(2)$X$为$O$、$Z$为$S$,$O$、$S$同主族$S$比$O$电子层数多一层,所以原子半径$Z$大于$X$,故选$C$;$X$为$O$、$Y$为$F$,$O^{2 - }$和$F^{-}$有着相同的电子层结构,$F$的核电荷数更大,所以$F^{-}$半径更小,故选$A$;
(3)含$N$元素的 10 电子离子有:$NH_{4}^{+}$、$NH_{2}^{-}$;除含$O$元素外,还含一种元素的 18 电子微粒有:$H_{2}O_{2}$。]
(1)
 $[\ddot{N}:]^{3 - }$
$[\ddot{N}:]^{3 - }$ (2)C A
(3)$NH_{4}^{+}$或$NH_{2}^{-}$ $H_{2}O_{2}$ 解析 $W$、$X$、$Y$、$Z$四种前 20 号元素,且原子序数依次增大。$X$原子的最外层电子数是次外层电子数的 3 倍,则$X$为氧元素,$X$、$Z$原子最外层电子数相同,则$Z$为硫元素,$Y$元素的负离子核外电子排布和氖原子相同,且$Y$原子序数大于氧元素,$Y$为氟元素。$Y$原子的最外层电子数与$W$原子的核外电子总数相等,则$W$为氮元素。综上所述,$W$、$X$、$Y$、$Z$分别为$N$、$O$、$F$、$S$。
(1)$Y$为$F$,其原子的结构示意图为
 ,$W$是$N$,其离子的电子式是$[\ddot{N}:]^{3 - }$;
,$W$是$N$,其离子的电子式是$[\ddot{N}:]^{3 - }$;(2)$X$为$O$、$Z$为$S$,$O$、$S$同主族$S$比$O$电子层数多一层,所以原子半径$Z$大于$X$,故选$C$;$X$为$O$、$Y$为$F$,$O^{2 - }$和$F^{-}$有着相同的电子层结构,$F$的核电荷数更大,所以$F^{-}$半径更小,故选$A$;
(3)含$N$元素的 10 电子离子有:$NH_{4}^{+}$、$NH_{2}^{-}$;除含$O$元素外,还含一种元素的 18 电子微粒有:$H_{2}O_{2}$。]
10. 下列说法中正确的是(
A.某微粒核外电子排布为 2、8、8 结构,则该微粒一定是氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.$F^{-}$、$Na^{+}$、$Al^{3 + }$是与氖原子具有相同电子层结构的离子
D.某元素原子的最外层只有 2 个电子,则该元素一定是金属元素
C
)A.某微粒核外电子排布为 2、8、8 结构,则该微粒一定是氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.$F^{-}$、$Na^{+}$、$Al^{3 + }$是与氖原子具有相同电子层结构的离子
D.某元素原子的最外层只有 2 个电子,则该元素一定是金属元素
答案:
C [A 项,某微粒核外电子排布为 2、8、8 结构,不一定是氩原子,可能是氯离子、钾离子等;B 项,最外层电子达到稳定结构的微粒不一定是稀有气体的原子,也可能是处于稳定结构的阴离子或阳离子;C 项,$F^{-}$、$Na^{+}$、$Al^{3 + }$都有 2 个电子层,第一层上有 2 个电子,第二层上有 8 个电子,与氖原子电子层结构相同;D 项,原子的最外层只有 2 个电子,该元素不一定是金属元素,也可能是$He$。]
11. (2024·江西上饶高一期末)类比和推理是化学研究的重要方法。下列应用该方法正确的是(
A.铁和氯气反应生成$FeCl_{3}$,则铁和碘单质也生成$FeI_{3}$
B.$Cl_{2}$与水反应生成 HClO 和 HCl,则$F_{2}$与水反应也能生成 HFO 和 HF
C.铁能从硫酸铜溶液中置换出铜,则钠也能从硫酸铜溶液中置换出铜
D.Fe 能与$Cu(NO_{3})_{2}$溶液反应,则 Fe 也能与$AgNO_{3}$溶液反应
D
)A.铁和氯气反应生成$FeCl_{3}$,则铁和碘单质也生成$FeI_{3}$
B.$Cl_{2}$与水反应生成 HClO 和 HCl,则$F_{2}$与水反应也能生成 HFO 和 HF
C.铁能从硫酸铜溶液中置换出铜,则钠也能从硫酸铜溶液中置换出铜
D.Fe 能与$Cu(NO_{3})_{2}$溶液反应,则 Fe 也能与$AgNO_{3}$溶液反应
答案:
D [碘的氧化性弱于氯气,与铁共热反应只能生成碘化亚铁,不能生成碘化铁,A 错误;氟气的氧化性强于氧气,与水反应生成氢氟酸和氧气,B 错误。]
12. 元素 R、X、T、Z、Q 在元素周期表中的相对位置如下表所示,其中 T 的单质常用作自来水消毒。则下列判断正确的是 (
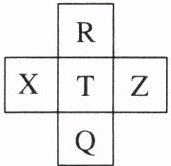
A.氧化物的水化物的酸性:$T>Q$
B.气态氢化物稳定性$R>T>Q$
C.R 与 Q 的电子数相差 16
D.非金属性:$Z>T>X$
B
)
A.氧化物的水化物的酸性:$T>Q$
B.气态氢化物稳定性$R>T>Q$
C.R 与 Q 的电子数相差 16
D.非金属性:$Z>T>X$
答案:
B [$T$的单质常用作自来水消毒,$T$是$Cl$元素;根据元素$R$、$X$、$T$、$Z$、$Q$在元素周期表中的相对位置,$R$是$F$元素、$X$是$S$元素、$Z$是$Ar$元素、$Q$是$Br$元素。A 项,$Cl$的氧化物的水化物的酸性不一定大于$Br$,如$HClO$的酸性小于$HBrO_{4}$;B 项,同主族元素从上到下,非金属性减弱,气态氢化物稳定性$HF\gt HCl\gt HBr$;C 项,$F$原子的电子数是 9,$Br$原子的电子数是 35,电子数相差 26;D 项,$Ar$是稀有气体,性质稳定,非金属性:$T\gt X\gt Z$。]
13. 在学习元素周期表后,某化学兴趣小组在老师的指导下,设计实验以探究元素性质的递变规律。为了验证卤族部分元素性质递变规律,设计如图所示装置(夹持装置已略去)进行实验。
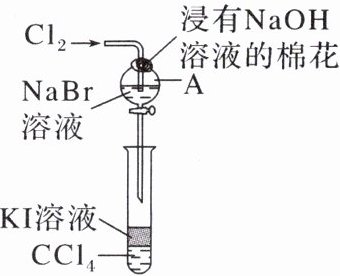
(1)指出溴元素在元素周期表中的位置:
(2)A 中发生反应的离子方程式是
(3)向 A 中通入$Cl_{2}$充分反应后,将 A 中液体滴入试管内,取下试管,充分振荡,静置,可观察到的现象是
(4)根据上述实验操作步骤,为确保“非金属性:$Cl>Br>I$”的实验结论可靠,你认为做好本实验的最关键因素是
(5)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
a.$Cl_{2}$、$Br_{2}$、$I_{2}$的熔点逐渐升高
b.HCl、HBr、HI 的稳定性逐渐减弱
c.HCl、HBr、HI 的酸性逐渐减弱
d.$Cl^{-}$、$Br^{-}$、$I^{-}$的还原性逐渐增强

(1)指出溴元素在元素周期表中的位置:
第四周期第ⅦA 族
。(2)A 中发生反应的离子方程式是
2Br⁻+Cl₂=Br₂+2Cl⁻
。(3)向 A 中通入$Cl_{2}$充分反应后,将 A 中液体滴入试管内,取下试管,充分振荡,静置,可观察到的现象是
液体分层,上层几乎无色,下层呈紫红色
($I_{2}易溶于CCl_{4}$,液体呈紫红色)。(4)根据上述实验操作步骤,为确保“非金属性:$Cl>Br>I$”的实验结论可靠,你认为做好本实验的最关键因素是
氯气通入少(适)量
。(5)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
bd
(填字母)。a.$Cl_{2}$、$Br_{2}$、$I_{2}$的熔点逐渐升高
b.HCl、HBr、HI 的稳定性逐渐减弱
c.HCl、HBr、HI 的酸性逐渐减弱
d.$Cl^{-}$、$Br^{-}$、$I^{-}$的还原性逐渐增强
答案:
(1)第四周期第ⅦA 族
(2)$2Br^{-}+Cl_{2}=Br_{2}+2Cl^{-}$
(3)液体分层,上层几乎无色,下层呈紫红色;
(4)氯气通入少(适)量
(5)bd 解析
(1)$Br$为第 35 号元素,位于元素周期表的第四周期第ⅦA 族。
(2)向$A$中通入氯气,氯气与溴化钠溶液反应生成氯化钠和溴,反应的离子方程式为$2Br^{-}+Cl_{2}=Br_{2}+2Cl^{-}$。
(3)向$A$中通入$Cl_{2}$充分反应后,反应生成的$Br_{2}$可以与试管中的$KI$溶液反应生成$I_{2}$。根据题图,$CCl_{4}$与水不能互溶,且$CCl_{4}$密度大于水,则液体分层,$I_{2}$易溶于$CCl_{4}$,则下层液体呈紫红色,上层液体几乎无色。
(4)为保证氯气只与$Br^{-}$反应而不溶于溴水中,应保证氯气通入适量。
(5)卤素单质的熔点不能作为判断元素非金属性强弱的依据,a 错误;$HCl$、$HBr$、$HI$的稳定性逐渐减弱,说明$Cl_{2}$、$Br_{2}$、$I_{2}$与氢气的化合反应逐渐变难,元素非金属性逐渐减弱,b 正确;无氧酸的酸性不能作为判断元素非金属性强弱的依据,c 错误;$Cl^{-}$、$Br^{-}$、$I^{-}$的还原性逐渐增强,说明$Cl^{-}$、$Br^{-}$、$I^{-}$的失电子能力逐渐增强,元素非金属性逐渐减弱,d 正确。
(1)第四周期第ⅦA 族
(2)$2Br^{-}+Cl_{2}=Br_{2}+2Cl^{-}$
(3)液体分层,上层几乎无色,下层呈紫红色;
(4)氯气通入少(适)量
(5)bd 解析
(1)$Br$为第 35 号元素,位于元素周期表的第四周期第ⅦA 族。
(2)向$A$中通入氯气,氯气与溴化钠溶液反应生成氯化钠和溴,反应的离子方程式为$2Br^{-}+Cl_{2}=Br_{2}+2Cl^{-}$。
(3)向$A$中通入$Cl_{2}$充分反应后,反应生成的$Br_{2}$可以与试管中的$KI$溶液反应生成$I_{2}$。根据题图,$CCl_{4}$与水不能互溶,且$CCl_{4}$密度大于水,则液体分层,$I_{2}$易溶于$CCl_{4}$,则下层液体呈紫红色,上层液体几乎无色。
(4)为保证氯气只与$Br^{-}$反应而不溶于溴水中,应保证氯气通入适量。
(5)卤素单质的熔点不能作为判断元素非金属性强弱的依据,a 错误;$HCl$、$HBr$、$HI$的稳定性逐渐减弱,说明$Cl_{2}$、$Br_{2}$、$I_{2}$与氢气的化合反应逐渐变难,元素非金属性逐渐减弱,b 正确;无氧酸的酸性不能作为判断元素非金属性强弱的依据,c 错误;$Cl^{-}$、$Br^{-}$、$I^{-}$的还原性逐渐增强,说明$Cl^{-}$、$Br^{-}$、$I^{-}$的失电子能力逐渐增强,元素非金属性逐渐减弱,d 正确。
查看更多完整答案,请扫码查看


