2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
3. 关于下列装置或设备的有关说法正确的是(
A.A装置中电流表指针偏转时,铜电极上发生了氧化反应
B.若B装置中的电解质溶液为稀硫酸,则负极的电极反应为$H_{2}-2e^{-}+2OH^{-}= 2H_{2}O$
C.C装置中可燃物燃烧时的能量利用率比B装置工作时氢气的能量利用率低
D.D装置中Zn为原电池的负极
C
)A.A装置中电流表指针偏转时,铜电极上发生了氧化反应
B.若B装置中的电解质溶液为稀硫酸,则负极的电极反应为$H_{2}-2e^{-}+2OH^{-}= 2H_{2}O$
C.C装置中可燃物燃烧时的能量利用率比B装置工作时氢气的能量利用率低
D.D装置中Zn为原电池的负极
答案:
C [A 装置构成原电池,铜为正极,发生了还原反应,故 A 错误;若 B 装置中的电解质溶液为稀硫酸,则负极的电极反应为 H₂ - 2e⁻ = 2H⁺,故 B 错误;C 装置中可燃物燃烧时,化学能转化为热能、光能,能量利用率比 B 装置工作时氢气的能量利用率低,故 C 正确;D 装置中,煤油为非电解质,煤油无自由移动离子,装置不能构成原电池,故 D 错误。]
4. 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下: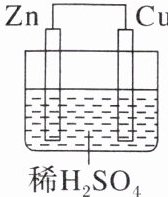
①Cu为负极,Zn为正极
②Cu电极上有气泡产生,发生还原反应
③$SO_{4}^{2-}$向Cu电极移动
④若有1mol电子流经导线,则可产生0.5mol气体
⑤电子的流向是$Cu→Zn$
⑥正极反应式为$Cu-2e^{-}= Cu^{2+}$,发生氧化反应
则卡片上的描述合理的是(
A.①②③
B.②④
C.②③④
D.③④⑤

①Cu为负极,Zn为正极
②Cu电极上有气泡产生,发生还原反应
③$SO_{4}^{2-}$向Cu电极移动
④若有1mol电子流经导线,则可产生0.5mol气体
⑤电子的流向是$Cu→Zn$
⑥正极反应式为$Cu-2e^{-}= Cu^{2+}$,发生氧化反应
则卡片上的描述合理的是(
B
)A.①②③
B.②④
C.②③④
D.③④⑤
答案:
B [Zn 和 Cu 形成的原电池,以稀硫酸作电解质溶液,Zn 是负极失去电子,电极反应:Zn - 2e⁻ = Zn²⁺,Cu 是正极,电极反应:2H⁺ + 2e⁻ = H₂↑。①据分析,Zn 为负极,Cu 为正极,①不合理;②Cu 电极上有气泡产生,发生还原反应,电极反应:2H⁺ + 2e⁻ = H₂↑,②合理;③原电池中阴离子朝负极移动,该电池中 SO₄²⁻向 Zn 电极移动,③不合理;④若有 1 mol 电子流经导线,据分析,2H⁺ + 2e⁻ = H₂↑,则可产生 0.5 mol 氢气,④合理;⑤电子的流向是从负极经外电路流向正极,Zn→Cu,⑤不合理;⑥Cu 为正极材料,起到导电作用,正极反应式为 2H⁺ + 2e⁻ = H₂↑,发生还原反应,⑥不合理;合理的是②④,故选 B。]
5. 下列关于原电池说法正确的是(
A.由Al、Mg、稀硫酸组成的原电池,其负极反应式为$Al-3e^{-}= Al^{3+}$
B.由Al、Mg、NaOH组成的原电池,其负极反应式为$Al-3e^{-}+3OH^{-}= Al(OH)_{3}\downarrow$
C.由Al、Cu、浓硝酸组成的原电池,其负极反应式为$Cu-2e^{-}= Cu^{2+}$
D.由Fe、Cu、$FeCl_{3}$组成的原电池,其正极反应式为$Cu-2e^{-}= Cu^{2+}$
C
)A.由Al、Mg、稀硫酸组成的原电池,其负极反应式为$Al-3e^{-}= Al^{3+}$
B.由Al、Mg、NaOH组成的原电池,其负极反应式为$Al-3e^{-}+3OH^{-}= Al(OH)_{3}\downarrow$
C.由Al、Cu、浓硝酸组成的原电池,其负极反应式为$Cu-2e^{-}= Cu^{2+}$
D.由Fe、Cu、$FeCl_{3}$组成的原电池,其正极反应式为$Cu-2e^{-}= Cu^{2+}$
答案:
C [在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。镁比铝活泼,A 中镁是负极,铝是正极,A 不正确;由于能和氢氧化钠反应的是铝,而镁不反应,所以选项 B 中铝是负极,镁是正极,但氢氧化钠是过量的,所以负极得不到氢氧化铝沉淀,而是生成四羟基合铝酸钠,B 不正确;铝比铜活泼,但在浓硝酸中铝钝化,所以铜是负极,C 正确;铁比铜活泼,D 中铁是负极,铜是正极,溶液中的铁离子在正极得到电子,所以选项 D 不正确。]
6. 把X、Y、Z、W四种金属浸入稀硫酸中,用导线两两相连,均可形成原电池。X、Y相连时,X为负极;Z、W相连时,W上有气泡逸出;X、Z相连时,X质量减少;Y、W相连时,电流从Y经导线流向W。则四种金属的活动性顺序由弱到强排列为(
A.X、Z、W、Y
B.W、Y、Z、X
C.W、Z、Y、X
D.Y、W、Z、X
D
)A.X、Z、W、Y
B.W、Y、Z、X
C.W、Z、Y、X
D.Y、W、Z、X
答案:
D [X、Y 相连时,X 为负极,则活泼性:X > Y;Z、W 相连时,W 上有气泡逸出,则活泼性:Z > W;X、Z 相连时,X 质量减少,X 为负极,则活泼性:X > Z;Y、W 相连时,电流从 Y 经导线流向 W,Y 为正极,则活泼性:W > Y。综上所述,四种金属的活动性顺序由弱到强排列为 Y、W、Z、X。]
7. 下列关于四种电池的叙述正确的是(
A.电池Ⅰ中电子的流向:$Zn→Cu→稀硫酸→Zn$
B.电池Ⅱ中石墨棒上发生还原反应,$MnO_{2}$作催化剂
C.电池Ⅲ是二次电池,充电时电能转化为化学能
D.电池Ⅳ中正极的电极反应式:$O_{2}+2H_{2}O+4e^{-}= 4OH^{-}$
C
)A.电池Ⅰ中电子的流向:$Zn→Cu→稀硫酸→Zn$
B.电池Ⅱ中石墨棒上发生还原反应,$MnO_{2}$作催化剂
C.电池Ⅲ是二次电池,充电时电能转化为化学能
D.电池Ⅳ中正极的电极反应式:$O_{2}+2H_{2}O+4e^{-}= 4OH^{-}$
答案:
C [A 项,电池Ⅰ为原电池,Zn 作负极,电子从锌流出沿导线流向铜,电子不能通过电解质溶液;B 项,电池Ⅱ为锌锰干电池,锌作负极,石墨作正极,MnO₂在正极得电子发生还原反应,为氧化剂;C 项,电池Ⅲ为铅蓄电池,是二次电池,充电时将电能转化为化学能;D 项,电池Ⅳ为酸性氢氧燃料电池,氧气在正极反应,电极反应式为 O₂ + 4H⁺ + 4e⁻ = 2H₂O。]
8. 国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是(
A.电池工作时,电解质溶液中的$H^{+}$向b极移动
B.a极发生的电极反应为$H_{2}+2e^{-}+2OH^{-}= 2H_{2}O$
C.b极为正极,发生氧化反应
D.当外电路有1mol电子转移时,b极消耗5.6L$O_{2}$
A
)A.电池工作时,电解质溶液中的$H^{+}$向b极移动
B.a极发生的电极反应为$H_{2}+2e^{-}+2OH^{-}= 2H_{2}O$
C.b极为正极,发生氧化反应
D.当外电路有1mol电子转移时,b极消耗5.6L$O_{2}$
答案:
A [电池工作时,H⁺移向正极,故 A 正确;a 极发生的电极反应为 H₂ - 2e⁻ = 2H⁺,故 B 错误;b 极为正极,发生还原反应,故 C 错误;未标明是否在标准状况下,无法计算,故 D 错误。]
9. A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。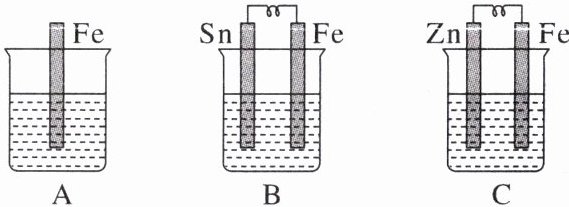
(1)A中反应的离子方程式为
(2)B中锡极为
(3)C中被氧化的金属是
(4)A、B、C中铁被氧化由快到慢的顺序是

(1)A中反应的离子方程式为
Fe + 2H⁺ = Fe²⁺ + H₂↑
。(2)B中锡极为
正
极,电极反应式为2H⁺ + 2e⁻ = H₂↑
,锡极附近溶液的酸性减弱
(填“增强”“减弱”或“不变”)。B中Fe极为负
极,电极反应式为Fe - 2e⁻ = Fe²⁺
。(3)C中被氧化的金属是
Zn
,总反应的化学方程式为Zn + H₂SO₄ = ZnSO₄ + H₂↑
。(4)A、B、C中铁被氧化由快到慢的顺序是
B > A > C
。
答案:
(1)Fe + 2H⁺ = Fe²⁺ + H₂↑
(2)正 2H⁺ + 2e⁻ = H₂↑ 减弱 负 Fe - 2e⁻ = Fe²⁺
(3)Zn Zn + H₂SO₄ = ZnSO₄ + H₂↑
(4)B > A > C解析
(1)A 中不能形成原电池,铁与稀硫酸发生置换反应。B 中能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁被氧化的速率加快。C 能形成原电池,锌比铁活泼,锌为负极,不断被氧化,铁为正极,保持不变。
(1)Fe + 2H⁺ = Fe²⁺ + H₂↑
(2)正 2H⁺ + 2e⁻ = H₂↑ 减弱 负 Fe - 2e⁻ = Fe²⁺
(3)Zn Zn + H₂SO₄ = ZnSO₄ + H₂↑
(4)B > A > C解析
(1)A 中不能形成原电池,铁与稀硫酸发生置换反应。B 中能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁被氧化的速率加快。C 能形成原电池,锌比铁活泼,锌为负极,不断被氧化,铁为正极,保持不变。
查看更多完整答案,请扫码查看


