2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
10. 下列说法错误的是(
A.鉴别$Na_2CO_3$和$NaHCO_3$可用$Ba(OH)_2$或$Ca(OH)_2$溶液
B.除去$Na_2CO_3$固体中混有的少量$NaHCO_3,$可采用加热法
$C.CO_2$中混有少量HCl气体时,可用饱和$NaHCO_3$溶液提纯气体
D.将澄清石灰水滴入$NaHCO_3$溶液中,开始时发生反应的离子方程式为$Ca^2⁺ + 2OH⁻ + 2HCO_3⁻ = CaCO_3↓ + CO_3^2⁻ + 2H_2O$
A
)A.鉴别$Na_2CO_3$和$NaHCO_3$可用$Ba(OH)_2$或$Ca(OH)_2$溶液
B.除去$Na_2CO_3$固体中混有的少量$NaHCO_3,$可采用加热法
$C.CO_2$中混有少量HCl气体时,可用饱和$NaHCO_3$溶液提纯气体
D.将澄清石灰水滴入$NaHCO_3$溶液中,开始时发生反应的离子方程式为$Ca^2⁺ + 2OH⁻ + 2HCO_3⁻ = CaCO_3↓ + CO_3^2⁻ + 2H_2O$
答案:
A [鉴别Na₂CO₃和NaHCO₃可用Ba(OH)₂或Ca(OH)₂溶液,A错误;除去Na₂CO₃固体中混有的少量NaHCO₃,可采用加热法,B正确;HCl可以和NaHCO₃溶液反应,但CO₂不与NaHCO₃反应,因此可用饱和NaHCO₃溶液吸收CO₂中混有的HCl气体,C正确;将澄清石灰水滴入NaHCO₃溶液中,开始时Ca(OH)₂的量较少,发生反应的离子方程式为Ca²⁺ + 2OH⁻ + 2HCO₃⁻ = CaCO₃↓ + CO₃²⁻ + 2H₂O,故D正确。]
11. 侯德榜先生是我国近代著名的化学家,他提出的联合制碱法得到世界各国的认可,主要化学反应为$NaCl + NH_3 + H_2O + CO_2 = NaHCO_3↓ + NH_4Cl。$工业流程如图,下列说法正确的是(
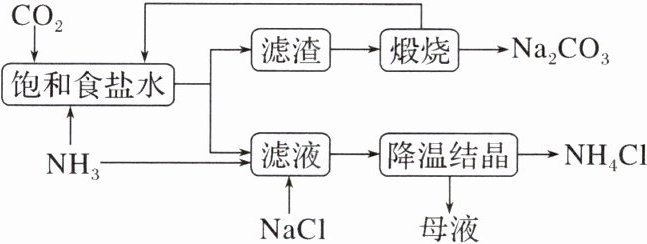
A.应该向饱和食盐水中先通入足量$NH_3,$再通入过量$CO_2$
B.该工艺流程中发生了复分解反应、分解反应、氧化还原反应
C.滤渣的主要成分是$Na_2CO_3,$在相同温度下碳酸氢钠溶解度比碳酸钠大
D.最终所得“母液”不可循环利用
A
)
A.应该向饱和食盐水中先通入足量$NH_3,$再通入过量$CO_2$
B.该工艺流程中发生了复分解反应、分解反应、氧化还原反应
C.滤渣的主要成分是$Na_2CO_3,$在相同温度下碳酸氢钠溶解度比碳酸钠大
D.最终所得“母液”不可循环利用
答案:
A [氨气极易溶于水,向饱和食盐水中通入氨气所得溶液呈碱性,继续通入过量二氧化碳形成碳酸氢钠的过饱和溶液,则析出碳酸氢钠晶体,主要反应为CO₂ + NH₃·H₂O = NH₄HCO₃、NH₄HCO₃ + NaCl = NaHCO₃↓ + NH₄Cl,可表示为CO₂ + NH₃ + H₂O + NaCl = NaHCO₃↓ + NH₄Cl,所得碳酸氢钠受热发生分解反应生成碳酸钠、水和二氧化碳,二氧化碳可以循环利用,向滤液中通入NH₃、加入食盐,通过降温结晶析出氯化铵晶体。应该向“饱和食盐水”中先通入足量NH₃,再通入过量CO₂,A正确;据分析,该工艺流程中没有发生氧化还原反应,B错误;滤渣的主要成分是NaHCO₃,在相同温度下碳酸氢钠溶解度比碳酸钠小,C错误;最终所得“母液”中含铵根离子、钠离子和氯离子,可循环利用,D错误。]
12. 向NaOH和$Na_2CO_3$的混合溶液中滴加$3.65 g·L⁻^1$的稀盐酸,生成的$CO_2$的质量与加入盐酸的体积的关系如图所示。下列判断正确的是(
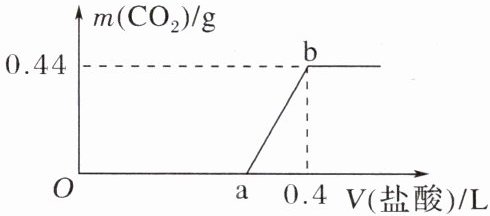
A.在O~a内,只发生酸碱中和反应
B.ab段发生反应的离子方程式为$CO_3^2⁻ + 2H⁺ = H_2O + CO_2↑$
C.a点表示的V(盐酸)= 0.3
D.原混合溶液中NaOH与$Na_2CO_3$的质量之比为1:2
C
)
A.在O~a内,只发生酸碱中和反应
B.ab段发生反应的离子方程式为$CO_3^2⁻ + 2H⁺ = H_2O + CO_2↑$
C.a点表示的V(盐酸)= 0.3
D.原混合溶液中NaOH与$Na_2CO_3$的质量之比为1:2
答案:
C [在O~a内,先发生氢离子与氢氧根离子的中和反应,再发生碳酸根离子与氢离子生成碳酸氢根离子的反应,A项错误;a点时的溶液为氯化钠和碳酸氢钠的混合溶液,所以ab段发生反应的离子方程式为HCO₃⁻ + H⁺ = H₂O + CO₂↑,B项错误;由ab段发生的反应NaHCO₃ + HCl = NaCl + H₂O + CO₂↑知,生成0.44g CO₂消耗盐酸为V,则3.65g·L⁻¹·V = $\frac{3.65×0.44g}{44}$,解得V = 0.1L,所以a表示的V(盐酸) = 0.3,C项正确;碳酸钠的质量是1.06g,生成碳酸氢根离子消耗的稀盐酸的体积是0.1L,则中和氢氧化钠消耗的稀盐酸的体积是0.3L - 0.1L = 0.2L,所以氢氧化钠的质量是3.65g·L⁻¹×0.2L×$\frac{40}{36.5}$ = 0.8g,原混合溶液中NaOH与Na₂CO₃的质量之比为$\frac{0.8g}{1.06g}$ = $\frac{40}{53}$,D项错误。]
13. (2024·河北沧州高一月考)膨松剂是在食品加工过程中加入的,能使面坯发起形成多孔组织的,使食品具有松软和酥脆特点的一类物质,其有效物质为$NaHCO_3。$某兴趣小组为研究某膨松剂的性质,设计了如下实验:
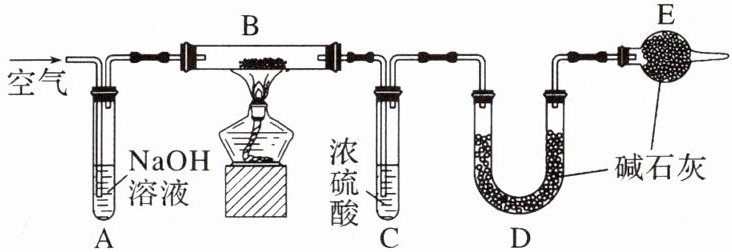
已知:
①碱石灰是固体氧化钙和氢氧化钠的混合物。装置气密性良好,且各装置中试剂皆过量。
②在加热情况下的产气量$(CO_2)$是检验膨松剂品质的一项重要指标。
(1)装置A中NaOH溶液的作用为
(2)将一定质量的膨松剂置于B中,B中发生的反应为
(3)实验时先连接好装置A、B和C,通入一段时间空气,再连接上装置D、E;点燃酒精灯开始实验;充分反应后停止加热,应继续通入一段时间空气,这样做的目的是
(4)实验结束后称量装置
(5)如果取5 g膨松剂样品,测得产气量为0.44 g,则该膨松剂的有效成分的百分含量为

已知:
①碱石灰是固体氧化钙和氢氧化钠的混合物。装置气密性良好,且各装置中试剂皆过量。
②在加热情况下的产气量$(CO_2)$是检验膨松剂品质的一项重要指标。
(1)装置A中NaOH溶液的作用为
除去空气中的二氧化碳
,装置E中碱石灰的作用为防止空气中的二氧化碳和水蒸气进入到装置D被吸收影响实验
。(2)将一定质量的膨松剂置于B中,B中发生的反应为
2NaHCO₃ $\xlongequal{\triangle}$ Na₂CO₃ + H₂O + CO₂↑
。(3)实验时先连接好装置A、B和C,通入一段时间空气,再连接上装置D、E;点燃酒精灯开始实验;充分反应后停止加热,应继续通入一段时间空气,这样做的目的是
将生成的二氧化碳全部赶入装置D中,让其全部被碱石灰吸收
。(4)实验结束后称量装置
D
的质量差即为膨松剂的产气量。(5)如果取5 g膨松剂样品,测得产气量为0.44 g,则该膨松剂的有效成分的百分含量为
33.6%
。
答案:
(1)除去空气中的二氧化碳 防止空气中的二氧化碳和水蒸气进入到装置D被吸收影响实验
(2)2NaHCO₃ $\xlongequal{\triangle}$ Na₂CO₃ + H₂O + CO₂↑
(3)将生成的二氧化碳全部赶入装置D中,让其全部被碱石灰吸收
(4)D
(5)33.6%
(1)除去空气中的二氧化碳 防止空气中的二氧化碳和水蒸气进入到装置D被吸收影响实验
(2)2NaHCO₃ $\xlongequal{\triangle}$ Na₂CO₃ + H₂O + CO₂↑
(3)将生成的二氧化碳全部赶入装置D中,让其全部被碱石灰吸收
(4)D
(5)33.6%
查看更多完整答案,请扫码查看


