2025年暑假作业黑龙江教育出版社高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假作业黑龙江教育出版社高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
4. 易拉罐的主要成分以铝铁合金和铝镁合金最为常见。现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是(
D
)
答案:
D [铝、铁、镁都可与盐酸反应产生无色气体,不能得出含铝、铁、镁三种金属的结论,A错误;铝、铁、镁三种金属中只有铝能与NaOH溶液反应产生无色气体,B错误;氢氧化镁与氢氧化铝均为白色沉淀,C错误;用盐酸溶解后生成的亚铁离子,在空气中易被氧化成Fe³+,加入KSCN溶液呈红色,D正确。]
5. 下列关于铝及其化合物反应的离子方程式书写正确的是(
A.铝与NaOH溶液反应:$Al+4OH⁻= Al[(OH)_4]⁻$
$B.Al_2O_3$与NaOH溶液反应:$Al_2O_3+OH⁻= Al[(OH)_4]⁻+H_2O$
C.明矾净水原理:$Al^3⁺+3H_2O⇌Al(OH)_3($胶体)+3H⁺
$D.Al_2(SO_4)_3$与过量氨水反应:$Al^3⁺+4NH_3·H_2O= Al[(OH)_4]⁻+4NH_4⁺$
C
)A.铝与NaOH溶液反应:$Al+4OH⁻= Al[(OH)_4]⁻$
$B.Al_2O_3$与NaOH溶液反应:$Al_2O_3+OH⁻= Al[(OH)_4]⁻+H_2O$
C.明矾净水原理:$Al^3⁺+3H_2O⇌Al(OH)_3($胶体)+3H⁺
$D.Al_2(SO_4)_3$与过量氨水反应:$Al^3⁺+4NH_3·H_2O= Al[(OH)_4]⁻+4NH_4⁺$
答案:
C [铝与NaOH溶液反应的离子方程式为2Al + 2OH⁻ + 6H₂O=2[Al(OH)₄]⁻ + 3H₂↑,A错误;Al₂O₃与NaOH溶液反应的离子方程式为Al₂O₃ + 2OH⁻ + 3H₂O=2[Al(OH)₄]⁻,B错误;明矾溶于水后电离产生的铝离子发生水解,产生的氢氧化铝胶体能吸附悬浮物,起到净水作用,C正确;一水合氨为弱碱,故氢氧化铝无法与一水合氨发生反应。]
6. (2024·安徽六安二中高一期末)下列物质中既能与稀$H_2SO_4$反应,又能与NaOH溶液反应的是(
$①NaHCO_3 ②Al_2O_3 ③Na_2CO_3 ④Al(OH)_3 ⑤NaHSO_4$
A.②③④
B.①③④
C.①②④
D.全部
C
) $①NaHCO_3 ②Al_2O_3 ③Na_2CO_3 ④Al(OH)_3 ⑤NaHSO_4$
A.②③④
B.①③④
C.①②④
D.全部
答案:
C [③Na₂CO₃与稀H₂SO₄反应,与NaOH溶液不反应;⑤NaHSO₄与稀H₂SO₄不反应,与NaOH溶液反应;①②④符合题意。]
7. 铝热反应的实验装置如图所示,下列有关说法错误的是(
A.X物质为$KClO_3$
B.镁条燃烧提供引发反应所需的热量
C.若转移0.3mol电子,被还原的$Fe_2O_3$为16g
D.可利用铝热反应冶炼铁
C
)A.X物质为$KClO_3$
B.镁条燃烧提供引发反应所需的热量
C.若转移0.3mol电子,被还原的$Fe_2O_3$为16g
D.可利用铝热反应冶炼铁
答案:
C [A项,KClO₃受热分解产生氧气,助燃,图示装置中X物质为助燃剂KClO₃,正确;B项,镁条燃烧放出大量热,可为铝热反应提供引发反应所需的热量,正确;C项,反应2Al + Fe₂O₃高温Al₂O₃ + 2Fe中,Fe元素化合价从+3价变为0价,还原1 mol Fe₂O₃转移6 mol电子,则转移0.3 mol电子还原Fe₂O₃的物质的量为0.3 mol6=0.05 mol,其质量为160 g·mol⁻¹×0.05 mol=8 g,错误;D项,Fe的活泼性小于Al,可利用铝热反应冶炼铁,正确。]
8. 从铝土矿(主要成分为$Al_2O_3)$中提取铝的工艺流程如图。下列说法不正确的是(
A.从$Na[Al(OH)_4]→Al(OH)_3→Al_2O_3$的转化过程中涉及的反应均为非氧化还原反应
B.Al_2O_3$与NaOH溶液反应的化学方程式:$Al_2O_3+2NaOH+3H_2O= 2Na[Al(OH)_4]$$
$C.Na[Al(OH)_4]$生成$Al(OH)_3$的离子方程式:$Al[(OH)_4]⁻+CO_2= Al(OH)_3↓+HCO_3⁻$
D.电解熔融$Al_2O_3$阳极的电极反应式:$Al^3⁺+3e⁻= Al$
D
)A.从$Na[Al(OH)_4]→Al(OH)_3→Al_2O_3$的转化过程中涉及的反应均为非氧化还原反应
B.Al_2O_3$与NaOH溶液反应的化学方程式:$Al_2O_3+2NaOH+3H_2O= 2Na[Al(OH)_4]$$
$C.Na[Al(OH)_4]$生成$Al(OH)_3$的离子方程式:$Al[(OH)_4]⁻+CO_2= Al(OH)_3↓+HCO_3⁻$
D.电解熔融$Al_2O_3$阳极的电极反应式:$Al^3⁺+3e⁻= Al$
答案:
D [向Na[Al(OH)₄]溶液中通入CO₂气体,发生反应生成Al(OH)₃,Al(OH)₃不稳定,受热分解产生Al₂O₃,在上述转化过程中无元素化合价的变化,因此涉及的反应均为非氧化还原反应,A正确;Al₂O₃是两性氧化物,与NaOH溶液反应产生Na[Al(OH)₄]和水,B正确;酸性:H₂CO₃ > Al(OH)₃,向Na[Al(OH)₄]溶液中通入过量CO₂气体,反应产生Al(OH)₃、NaHCO₃,该反应的离子方程式为[Al(OH)₄]⁻ + CO₂=Al(OH)₃↓ + HCO₃⁻,C正确;电解熔融Al₂O₃时,阳极上O²⁻失去电子变为O₂,电极反应式为2O²⁻ - 4e⁻=O₂↑,D错误。]
9. 铁和铝是科技、生产、生活中应用最广泛的金属材料。现有铁、铝的混合物进行如下实验:
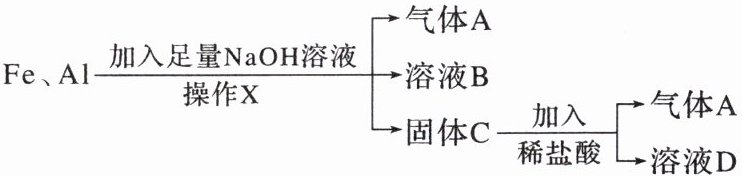
(1)操作X的名称是
(2)气体A是
(3)A与$Cl_2$混合光照可能发生爆炸,生成
(4)溶液B中阴离子除OH⁻外还有

(1)操作X的名称是
过滤
。(2)气体A是
H₂
。(3)A与$Cl_2$混合光照可能发生爆炸,生成
HCl
(填化学式),A在该反应中作为还原剂
(填“氧化剂”或“还原剂”)。(4)溶液B中阴离子除OH⁻外还有
[Al(OH)₄]⁻
,溶液D中存在的金属离子为Fe²⁺
。
答案:
(1)过滤
(2)H₂
(3)HCl 还原剂
(4)[Al(OH)₄]⁻ Fe²⁺
(1)过滤
(2)H₂
(3)HCl 还原剂
(4)[Al(OH)₄]⁻ Fe²⁺
10. 某无色溶液中可能含有H⁺、$Mg^2⁺、$$NH_4⁺、$$Al^3⁺、$$Fe^3⁺、$$CO_3^2⁻、$$SO_4^2⁻$中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是(
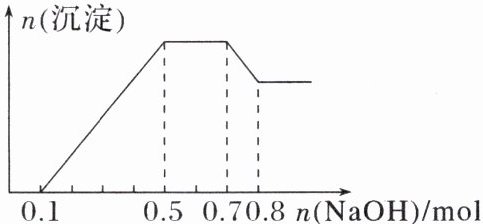
A.溶液中的阳离子有H⁺、$Mg^2⁺、$$NH_4⁺、$$Al^3⁺$
B.溶液中$n(Al^3⁺)= 0.1mol$
C.溶液中一定不含$CO_3^2⁻,$一定含有$SO_4^2⁻$
$D.n(H⁺):n(Al^3⁺):n(Mg^2⁺)= 1:1:1$
D
)
A.溶液中的阳离子有H⁺、$Mg^2⁺、$$NH_4⁺、$$Al^3⁺$
B.溶液中$n(Al^3⁺)= 0.1mol$
C.溶液中一定不含$CO_3^2⁻,$一定含有$SO_4^2⁻$
$D.n(H⁺):n(Al^3⁺):n(Mg^2⁺)= 1:1:1$
答案:
D [若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是( )
A. 溶液中的阳离子有H⁺、Mg²⁺、NH₄⁺、Al³⁺
B. 溶液中n(Al³⁺)= 0.1mol
C. 溶液中一定不含CO₃²⁻,一定含有SO₄²⁻
D. n(H⁺):n(Al³⁺):n(Mg²⁺)= 1:1:1
解析:若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO₃²⁻不能大量存在;若加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg²⁺、Al³⁺;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH₄⁺,由于溶液中还必须存在阴离子,所以一定还有SO₄²⁻;由图可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1 mol,则n(H⁺)=0.1 mol;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7 mol-0.5 mol=0.2 mol,则n(NH₄⁺)=0.2 mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8 mol-0.7 mol=0.1 mol,则n[Al(OH)₃]=0.1 mol,根据铝元素守恒可知n(Al³⁺)=0.1 mol;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5 mol-0.1 mol=0.4 mol,则n(Mg²⁺)=(0.4 mol-0.1 mol×3)×12=0.05 mol。A.由分析可知,由上述分析可知,溶液中的阳离子只有H⁺、Mg²⁺、Al³⁺、NH₄⁺,故A正确;B.由上述分析可知,溶液中n(Al³⁺)=0.1 mol,故B正确;C.由上述分析可知,溶液中一定不含CO₃²⁻,一定含有SO₄²⁻,故C正确;D.由上述分析可知,溶液中n(H⁺):n(Al³⁺):n(Mg²⁺)=0.1 mo:0.1 mol:0.05 mol=2:2:1,故D错误。]
A. 溶液中的阳离子有H⁺、Mg²⁺、NH₄⁺、Al³⁺
B. 溶液中n(Al³⁺)= 0.1mol
C. 溶液中一定不含CO₃²⁻,一定含有SO₄²⁻
D. n(H⁺):n(Al³⁺):n(Mg²⁺)= 1:1:1
解析:若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO₃²⁻不能大量存在;若加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg²⁺、Al³⁺;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH₄⁺,由于溶液中还必须存在阴离子,所以一定还有SO₄²⁻;由图可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1 mol,则n(H⁺)=0.1 mol;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7 mol-0.5 mol=0.2 mol,则n(NH₄⁺)=0.2 mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8 mol-0.7 mol=0.1 mol,则n[Al(OH)₃]=0.1 mol,根据铝元素守恒可知n(Al³⁺)=0.1 mol;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5 mol-0.1 mol=0.4 mol,则n(Mg²⁺)=(0.4 mol-0.1 mol×3)×12=0.05 mol。A.由分析可知,由上述分析可知,溶液中的阳离子只有H⁺、Mg²⁺、Al³⁺、NH₄⁺,故A正确;B.由上述分析可知,溶液中n(Al³⁺)=0.1 mol,故B正确;C.由上述分析可知,溶液中一定不含CO₃²⁻,一定含有SO₄²⁻,故C正确;D.由上述分析可知,溶液中n(H⁺):n(Al³⁺):n(Mg²⁺)=0.1 mo:0.1 mol:0.05 mol=2:2:1,故D错误。]
查看更多完整答案,请扫码查看


