第89页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
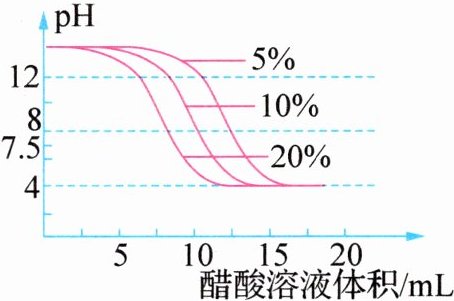
6. (2024·广东深圳)扬扬同学发现染布前可以用盐酸洗去布料表面部分碱性物质(如 KOH),染色后用 5%、10%、20%的醋酸溶液与等浓度等质量的 KOH 溶液反应,pH 变化如右下图所示。下列选项正确的是 ( )
A. KOH 来源:Ca(OH)₂ + K₂CO₃ = CaCO₃↓ + KOH
B. 扬扬用盐酸清洗布料后不用水冲洗,因为盐酸没有腐蚀性
C. 如图所示,醋酸浓度越高所需醋酸溶液体积越大
D. 由图象可知,随着不同浓度的醋酸溶液用量的增加,pH 趋近于 4.0

A. KOH 来源:Ca(OH)₂ + K₂CO₃ = CaCO₃↓ + KOH
B. 扬扬用盐酸清洗布料后不用水冲洗,因为盐酸没有腐蚀性
C. 如图所示,醋酸浓度越高所需醋酸溶液体积越大
D. 由图象可知,随着不同浓度的醋酸溶液用量的增加,pH 趋近于 4.0
答案:
D【解析】该方程式未配平,应为Ca(OH)₂ + K₂CO₃ = CaCO₃↓ + 2KOH,故A错误;盐酸具有腐蚀性,故B错误;由题图可知,醋酸浓度越高,所需醋酸溶液体积越小,故C错误;由题图可知,随着不同浓度的醋酸溶液用量的增加,pH趋近于4.0,故D正确。
7. 新素养 科学探究与实践 在研究酸和碱的化学性质时。某小组的同学想证明:稀硫酸与 NaOH 溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实验和评价。
(1)方案一:
① 测定稀硫酸与 NaOH 溶液混合前后的 pH。测定某 NaOH 溶液的 pH,pH______(填“<”“>”或“=”)7。
② 将一定量的稀硫酸加入该 NaOH 溶液中,混合均匀后测定其 pH,pH<7。
③ 结论:稀硫酸与 NaOH 溶液发生了化学反应,并且______过量。
(2)方案二:观察______(根据图示实验步骤,概括方案要点)。
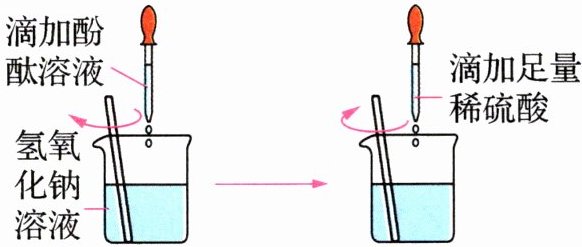
结论:稀硫酸与 NaOH 溶液发生了化学反应,反应的化学方程式为______。
(3)上述两个方案在设计思想上的相同点是______。
(1)方案一:
① 测定稀硫酸与 NaOH 溶液混合前后的 pH。测定某 NaOH 溶液的 pH,pH______(填“<”“>”或“=”)7。
② 将一定量的稀硫酸加入该 NaOH 溶液中,混合均匀后测定其 pH,pH<7。
③ 结论:稀硫酸与 NaOH 溶液发生了化学反应,并且______过量。
(2)方案二:观察______(根据图示实验步骤,概括方案要点)。

结论:稀硫酸与 NaOH 溶液发生了化学反应,反应的化学方程式为______。
(3)上述两个方案在设计思想上的相同点是______。
答案:
>@@稀硫酸@@稀硫酸加入滴有酚酞的氢氧化钠溶液中是否有颜色的改变@@H₂SO₄ + 2NaOH = Na₂SO₄ + 2H₂O@@测定反应前后溶液的酸碱性变化来确定两种溶液混合后是否发生了化学反应
8. 中和反应再探究。
【初步探究】在 50 mL 一定浓度的氢氧化钠溶液中滴加 2~3 滴无色酚酞溶液,再逐滴加入 50 mL 一定浓度的盐酸,插入温度计并用玻璃棒搅拌,观察到溶液褪色且温度升高。
(1)能推断出氢氧化钠溶液与盐酸能发生反应的现象是______,依据是______(填“反应物减少”或“生成物增加”)。
(2)从微观角度分析,此反应主要是由于______(填离子符号)两种离子发生了变化。
【深入探究】同学们又设计了以下实验验证反应中的能量变化。
① 50 mL 一定浓度的氢氧化钠溶液与 50 mL 蒸馏水混合,测量溶液温度的变化。
② 50 mL 一定浓度的稀盐酸与______混合,测量溶液温度的变化。
③ 50 mL 一定浓度的稀盐酸与 50 mL 一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得 3 个实验中溶液温度随时间变化的关系如右图所示。
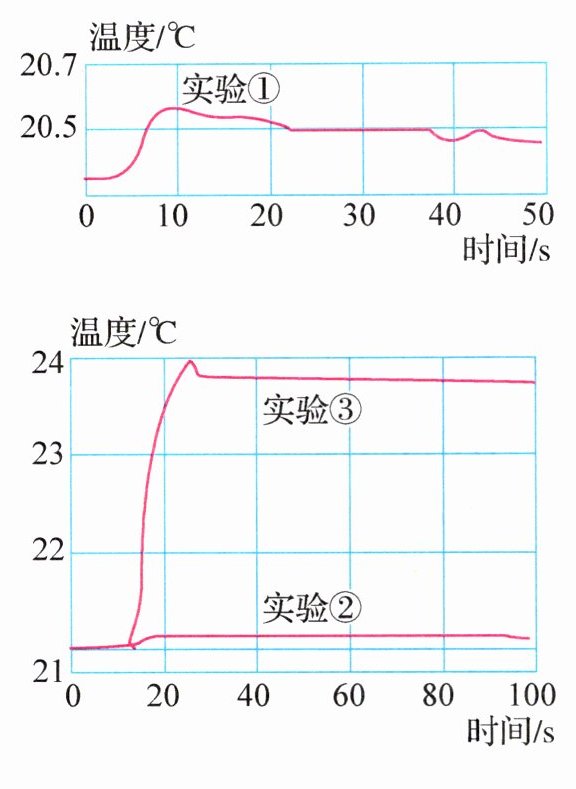
(3)由实验①可知:一定浓度的氢氧化钠溶液稀释时______(填“放热”或“吸热”)。
(4)实验②横线处应该填写的是______。
(5)由图分析,同学确认氢氧化钠与盐酸反应放出热量,理由是______。
【初步探究】在 50 mL 一定浓度的氢氧化钠溶液中滴加 2~3 滴无色酚酞溶液,再逐滴加入 50 mL 一定浓度的盐酸,插入温度计并用玻璃棒搅拌,观察到溶液褪色且温度升高。
(1)能推断出氢氧化钠溶液与盐酸能发生反应的现象是______,依据是______(填“反应物减少”或“生成物增加”)。
(2)从微观角度分析,此反应主要是由于______(填离子符号)两种离子发生了变化。
【深入探究】同学们又设计了以下实验验证反应中的能量变化。
① 50 mL 一定浓度的氢氧化钠溶液与 50 mL 蒸馏水混合,测量溶液温度的变化。
② 50 mL 一定浓度的稀盐酸与______混合,测量溶液温度的变化。
③ 50 mL 一定浓度的稀盐酸与 50 mL 一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得 3 个实验中溶液温度随时间变化的关系如右图所示。

(3)由实验①可知:一定浓度的氢氧化钠溶液稀释时______(填“放热”或“吸热”)。
(4)实验②横线处应该填写的是______。
(5)由图分析,同学确认氢氧化钠与盐酸反应放出热量,理由是______。
答案:
溶液颜色由红色变为无色@@反应物减少@@H⁺与OH⁻@@50 mL蒸馏水@@放热@@50 mL蒸馏水@@稀释溶液时温度的变化量远小于两种溶液混合后温度的变化量
查看更多完整答案,请扫码查看


