第10页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
1. 下列事实可用于判断 X、Y 两种金属的活动性顺序的是 ( )
① X 能与稀盐酸反应而 Y 不能 ② X 能从 Y 的化合物溶液中置换出 Y ③ 常温下 X 能与氧气反应而 Y 不能 ④ 在化合物中 X 为+3 价,Y 为+2 价
A. ①②
B. ①②③
C. ③④
D. ①②④
① X 能与稀盐酸反应而 Y 不能 ② X 能从 Y 的化合物溶液中置换出 Y ③ 常温下 X 能与氧气反应而 Y 不能 ④ 在化合物中 X 为+3 价,Y 为+2 价
A. ①②
B. ①②③
C. ③④
D. ①②④
答案:
B
2. (新素养 科学思维)(2023·山东菏泽)碲化镉薄膜电池是一种重要的太阳能电池,其材料之一镉(Cd)的制备是在铜镉渣(主要含有 Cd、Zn、Cu、Fe 单质)中加入足量的稀硫酸充分反应,过滤出铜渣,然后对滤液进行除铁净化,再加入锌粉置换出镉,下列金属的活动性顺序正确的是 ( )
A. Zn>Cu>Cd
B. Cu>Zn>Cd
C. Zn>Cd>Cu
D. Cd>Zn>Cu
A. Zn>Cu>Cd
B. Cu>Zn>Cd
C. Zn>Cd>Cu
D. Cd>Zn>Cu
答案:
C
3. (2024·江苏苏州月考)下图为探究铝和铜的金属活动性强弱的实验,下列说法不正确的是 ( )
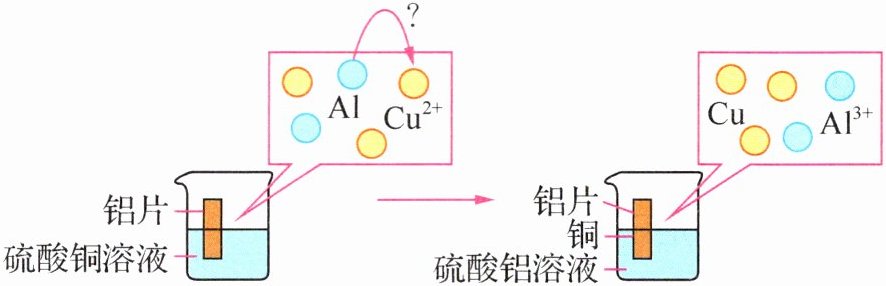
A. 在反应过程中,观察到溶液颜色由蓝色变为无色
B. 其反应的化学方程式为 Al+CuSO₄ = AlSO₄+Cu
C. 反应后固体的质量比反应前增大了
D. 根据铝片表面有红色固体析出可以得出铝的活动性比铜的强

A. 在反应过程中,观察到溶液颜色由蓝色变为无色
B. 其反应的化学方程式为 Al+CuSO₄ = AlSO₄+Cu
C. 反应后固体的质量比反应前增大了
D. 根据铝片表面有红色固体析出可以得出铝的活动性比铜的强
答案:
【解析】由题图可知,铝与硫酸铜溶液反应生成硫酸铝和铜,反应的化学方程式为2Al + 3CuSO₄ = Al₂(SO₄)₃ + 3Cu,反应后的溶液为硫酸铝溶液,呈无色,故A正确、B错误;铜的相对原子质量比铝的大,由反应的化学方程式可知,每54份质量的铝能置换出192份质量的铜,反应后固体的质量增大,故C正确;根据铝片表面有红色固体析出可以得出铝的活动性比铜的强,故D正确。
4. (2024·贵州安顺模拟改编)某校化学兴趣小组利用课余时间探究“金属的化学性质”。
(1)图甲中发生反应的化学方程式为 __________________(写出一个即可),化学小组设计图甲实验来验证铁、铜、银的金属活动性顺序,针对图中的方案,请再补充一个实验,即可达到实验目的,写出补充实验的操作及现象:______________________________。

(2)向硝酸铜、硝酸银和硝酸亚铁的混合溶液中连续、缓慢地加入 m g 锌粉,溶液中析出固体的质量与加入锌粉的质量关系如图乙所示。
① bc 段(不含两端点)反应析出的金属是 ________(填化学式,下同)。
② c 点对应溶液中的阳离子是 ____________________。
③ 若 ab 段和 bc 段析出固体的质量相等,参加反应的锌粉质量分别为 m₁ 和 m₂,则 m₁ 和 m₂ 的比值为 ______________(填最简整数比)。
(1)图甲中发生反应的化学方程式为 __________________(写出一个即可),化学小组设计图甲实验来验证铁、铜、银的金属活动性顺序,针对图中的方案,请再补充一个实验,即可达到实验目的,写出补充实验的操作及现象:______________________________。

(2)向硝酸铜、硝酸银和硝酸亚铁的混合溶液中连续、缓慢地加入 m g 锌粉,溶液中析出固体的质量与加入锌粉的质量关系如图乙所示。
① bc 段(不含两端点)反应析出的金属是 ________(填化学式,下同)。
② c 点对应溶液中的阳离子是 ____________________。
③ 若 ab 段和 bc 段析出固体的质量相等,参加反应的锌粉质量分别为 m₁ 和 m₂,则 m₁ 和 m₂ 的比值为 ______________(填最简整数比)。
答案:
(1)Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag(或Fe + 2HCl = FeCl₂ + H₂↑)把铜丝伸入盛有稀盐酸的试管中,无明显现象
(2)①Cu ②Zn²⁺、Fe²⁺ ③8 : 27
【解析】(2)根据金属活动性顺序Zn>Fe>(H)>Cu>Ag,向硝酸铜、硝酸银和硝酸亚铁的混合溶液中连续、缓慢地加入m g锌粉,ab段反应的化学方程式为Zn + 2AgNO₃ = Zn(NO₃)₂ + 2Ag,bc段反应的化学方程式为Zn + Cu(NO₃)₂ = Zn(NO₃)₂ + Cu,cd段反应的化学方程式为Zn + Fe(NO₃)₂ = Zn(NO₃)₂ + Fe。①由分析可知,bc段(不含两端点)反应析出的金属是铜。②b点硝酸银恰好完全反应,c点硝酸铜恰好完全反应,则对应溶液的阳离子是Zn²⁺、Fe²⁺。③由分析可知,ab段反应的化学方程式为Zn + 2AgNO₃ = Zn(NO₃)₂ + 2Ag,参与反应的锌和生成的银的质量比为65 : 216;bc段反应的化学方程式为Zn + Cu(NO₃)₂ = Zn(NO₃)₂ + Cu,参与反应的锌和生成的铜的质量比为65 : 64;若ab段和bc段析出的固体质量相等,参加反应的锌粉质量分别为m₁和m₂,则有216m₁/65 = 64m₂/65,则m₁ : m₂ = 64 : 216 = 8 : 27。
查看更多完整答案,请扫码查看


