第53页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
10.(2023·安徽亳州模拟节选)《天工开物》记载了海水制食盐的方法,已知海水中含有NaCl以及少量MgCl₂、CaCl₂,海边盐场制取NaCl的主要流程如下图所示。

(1)晒盐析出晶体的过程相当于实验室的________操作。
(2)母液为NaCl的________(填“饱和”或“不饱和”)溶液。
(3)收盐时MgCl₂、CaCl₂大多留在母液中,结合表中的数据,分析结晶时MgCl₂、CaCl₂含量很少的原因:______________________________。
|温度/℃|0|20|40|60|80|
|----|----|----|----|----|----|
|溶解度/g|NaCl|35.7|36|36.6|37.3|38.4|
|CaCl₂|59.5|74.5|116|137|147|
|MgCl₂|52.9|54.6|57.5|61|66.1|

(1)晒盐析出晶体的过程相当于实验室的________操作。
(2)母液为NaCl的________(填“饱和”或“不饱和”)溶液。
(3)收盐时MgCl₂、CaCl₂大多留在母液中,结合表中的数据,分析结晶时MgCl₂、CaCl₂含量很少的原因:______________________________。
|温度/℃|0|20|40|60|80|
|----|----|----|----|----|----|
|溶解度/g|NaCl|35.7|36|36.6|37.3|38.4|
|CaCl₂|59.5|74.5|116|137|147|
|MgCl₂|52.9|54.6|57.5|61|66.1|
答案:
蒸发@@饱和@@氯化钠的溶解度受温度变化的影响较小,氯化钙、氯化镁的溶解度受温度变化的影响较大,且海水中氯化钙、氯化镁含量较少,蒸发结晶时,氯化钠晶体大量析出,氯化钙、氯化镁含量较少,不会析出
11.(2024·江苏淮安模拟节选)某兴趣小组对粗盐提纯,并用制得的精盐制取氢氧化钠。下图为粗盐的提纯过程。
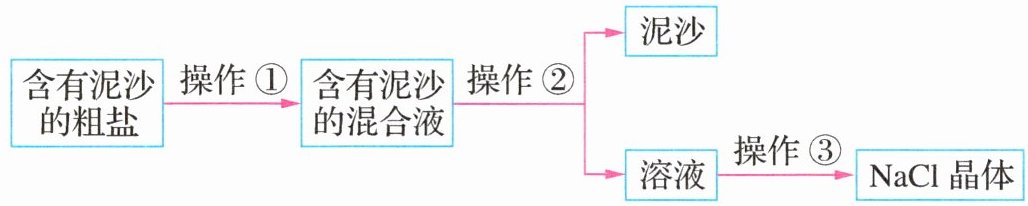
(1)其中操作③为________,操作②中玻璃棒的作用是________。
(2)若NaCl的产率偏低,则可能的原因是________(填字母)。
A. 过滤时滤纸有破损
B. 蒸发时有液体溅出
C. 溶解含有泥沙的粗盐时,加入的水量不足
(3)电解食盐水制氢氧化钠的化学方程式为2NaCl + 2H₂O ==通电== 2NaOH + H₂↑ + Cl₂↑,若要制得40 t氢氧化钠,理论上需氯化钠多少吨(写出计算过程)?

(1)其中操作③为________,操作②中玻璃棒的作用是________。
(2)若NaCl的产率偏低,则可能的原因是________(填字母)。
A. 过滤时滤纸有破损
B. 蒸发时有液体溅出
C. 溶解含有泥沙的粗盐时,加入的水量不足
(3)电解食盐水制氢氧化钠的化学方程式为2NaCl + 2H₂O ==通电== 2NaOH + H₂↑ + Cl₂↑,若要制得40 t氢氧化钠,理论上需氯化钠多少吨(写出计算过程)?
答案:
蒸发@@引流@@BC@@解:设若要制得40 t氢氧化钠,理论上需氯化钠的质量为x。
\[2NaCl + 2H_{2}O\xlongequal{通电}2NaOH + H_{2}\uparrow + Cl_{2}\uparrow\]
117 80
x 40 t
$\frac{117}{80}=\frac{x}{40 t}$ $x = 58.5 t$
答:若要制得40 t氢氧化钠,理论上需氯化钠58.5 t。
【解析】(2)过滤时滤纸有破损,会导致杂质进入滤液中,从而导致得到的氯化钠质量偏大,计算出的产率偏高,故A不符合题意;蒸发时有液体溅出,会导致氯化钠损失,从而导致得到的氯化钠质量偏小,计算出的产率偏低,故B符合题意;溶解有泥沙的粗盐时,加入的水量不足,会导致部分氯化钠损失,从而导致得到的氯化钠质量偏小,计算出的产率偏低,故C符合题意。
查看更多完整答案,请扫码查看


