第26页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
**例3** (2024·四川巴中改编)回收利用废旧金属既可以保护环境,又能节约资源和能源。回收 1 t 废钢铁可炼得好钢 0.9 t,与用矿石冶炼相比,可节省大约一半的成本。某实验小组设计了下图实验装置,利用烘干后的生锈铁粉样品模拟回收铁的过程。请回答下列问题。
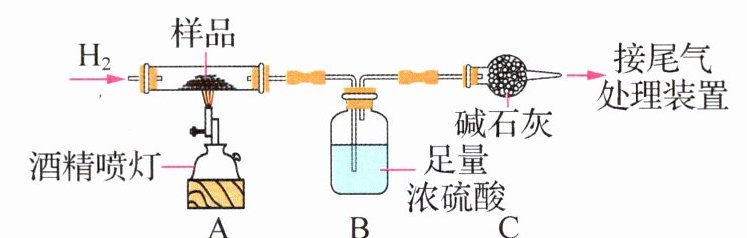
【查阅资料】① 氢气具有还原性;② 浓硫酸具有吸水性。
主要实验步骤:① 连接装置,检查装置的气密性;② 向装置 A 的硬质玻璃管中加入一定质量的上述样品;③ 先通入一段时间 H₂,称得反应前装置 B 的质量为 m₁;④ 点燃酒精喷灯,加热;⑤ 待完全反应后,停止加热,继续通入一段时间 H₂;⑥ 称得装置 B 的质量为 m₂。
(1)铁粉与空气中的 ________ 反应生成铁锈。
(2)装置 B 的作用是 ________ 。
(3)步骤③中先通入一段时间 H₂的目的是 ________________________ 。
(4)计算该反应生成 Fe 的质量为 ________ (填化简后的表达式)。

【查阅资料】① 氢气具有还原性;② 浓硫酸具有吸水性。
主要实验步骤:① 连接装置,检查装置的气密性;② 向装置 A 的硬质玻璃管中加入一定质量的上述样品;③ 先通入一段时间 H₂,称得反应前装置 B 的质量为 m₁;④ 点燃酒精喷灯,加热;⑤ 待完全反应后,停止加热,继续通入一段时间 H₂;⑥ 称得装置 B 的质量为 m₂。
(1)铁粉与空气中的 ________ 反应生成铁锈。
(2)装置 B 的作用是 ________ 。
(3)步骤③中先通入一段时间 H₂的目的是 ________________________ 。
(4)计算该反应生成 Fe 的质量为 ________ (填化简后的表达式)。
答案:
氧气和水(或O₂、H₂O)@@吸收水蒸气@@排出装置内的空气,防止加热时发生爆炸@@$\frac{56(m_2 - m_1)}{27}$@@【解析】(1)铁粉与空气中的氧气和水反应生成铁锈。(2)装置B利用了浓硫酸的吸水性,吸收反应生成的水蒸气。(3)氢气具有可燃性,与空气混合加热易发生爆炸,因此步骤③中先通入一段时间氢气的目的是排出装置内的空气,防止加热时发生爆炸。(4)铁锈的主要成分是氧化铁,氢气与氧化铁在高温条件下反应生成铁和水,浓硫酸具有吸水性,因此装置B增加的质量为生成水的质量,即m₂ - m₁,设生成铁的质量为x。
Fe₂O₃ + 3H₂ $\stackrel{高温}{=\!=\!=}$ 2Fe + 3H₂O
112 54
x m₂ - m₁
$\frac{112}{54}=\frac{x}{m_2 - m_1}$ ,x = $\frac{56(m_2 - m_1)}{27}$
故该反应生成铁的质量为$\frac{56(m_2 - m_1)}{27}$。
3. (2024·广东珠海模拟节选)铜是人类较早冶炼和使用的金属。
(1)火法炼铜。流程如图 1 所示。孔雀石的主要成分为碱式碳酸铜,受热易分解生成 CuO、H₂O 和 CO₂。
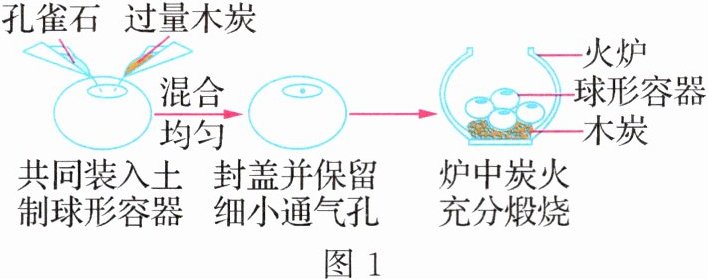
① 木炭的主要作用:a. 作燃料;b. 利用其 ________ 性与 CuO 反应生成 Cu。
② 球形容器封盖后保留通气孔的作用是 ________________________ 。
(2)电解法制铜。在电解池中发生反应的化学方程式为 2CuSO₄ + 2H₂O = 2Cu↓ + O₂↑ + 2H₂SO₄(反应条件略去)。该反应中化合价发生改变的元素有 ________ (填元素符号)。
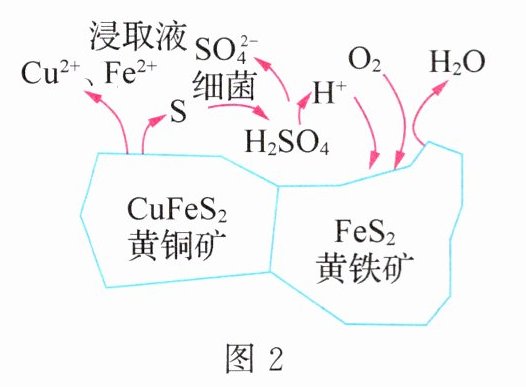
(3)细菌冶铜。从黄铁矿(主要成分为 FeS₂)和黄铜矿(主要成分为 CuFeS₂)中获得含 Cu²⁺的浸取液的原理如图 2 所示。
① 写出一种从含 Cu²⁺的浸取液中得到单质铜的方程式: ________________________ 。
② “细菌冶铜”相比另外两种方法的优点是 ________________________ (写出一点即可)。
(1)火法炼铜。流程如图 1 所示。孔雀石的主要成分为碱式碳酸铜,受热易分解生成 CuO、H₂O 和 CO₂。


① 木炭的主要作用:a. 作燃料;b. 利用其 ________ 性与 CuO 反应生成 Cu。
② 球形容器封盖后保留通气孔的作用是 ________________________ 。
(2)电解法制铜。在电解池中发生反应的化学方程式为 2CuSO₄ + 2H₂O = 2Cu↓ + O₂↑ + 2H₂SO₄(反应条件略去)。该反应中化合价发生改变的元素有 ________ (填元素符号)。
(3)细菌冶铜。从黄铁矿(主要成分为 FeS₂)和黄铜矿(主要成分为 CuFeS₂)中获得含 Cu²⁺的浸取液的原理如图 2 所示。
① 写出一种从含 Cu²⁺的浸取液中得到单质铜的方程式: ________________________ 。
② “细菌冶铜”相比另外两种方法的优点是 ________________________ (写出一点即可)。
答案:
还原@@排出气体,防止容器内部压强过大而炸裂@@Cu、O@@Fe + CuSO₄ = FeSO₄ + Cu(答案合理即可)@@节能(或环保、无酸性废液产生等)@@【解析】(1)①木炭具有还原性,故在火法炼铜的过程中,木炭的作用有两个,一是作燃料,提供热量,二是作还原剂,与氧化铜反应生成铜。②球形容器封盖后保留通气孔,是因为加热时气体膨胀,压强增大,如果没有通气孔,容器会因压强增大而炸裂。(3)①在金属活动性顺序中,排在铜前面的金属(钾、钙、钠除外)能把铜从它的盐溶液中置换出来,如Fe + CuSO₄ = FeSO₄ + Cu。②细菌冶铜过程中不需要消耗能源,没有有害物质生成。
4. **亮点原创** · 2024 年 8 月 16 日 15 时 35 分,我国在西昌卫星发射中心使用长征四号乙运载火箭,成功将遥感四十三号 01 组卫星发射升空,卫星顺利进入预定轨道,发射任务获得圆满成功。
(1)卫星的太阳能电池帆板用先进的砷化镓主板和铝合金边框制成,铝合金的硬度比纯铝的 ________ (填“大”或“小”)。
(2)制造人造卫星常用到钛合金,由钛铁矿(主要成分是 FeO 和 TiO₂)提取金属钛的主要工艺流程如下图所示。
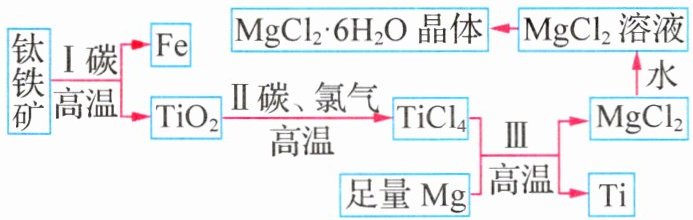
① 钛合金属于 ________ (填“金属材料”或“合成材料”)。
② 步骤Ⅰ中,FeO 与碳反应,其中体现还原性的是 ________ (填化学式)。
③ 步骤Ⅲ中发生反应的化学方程式为 ________ ,基本反应类型是 ________ 。
④ 从 MgCl₂溶液到 MgCl₂·6H₂O 晶体的过程是 ________ (填“物理”或“化学”)变化。
(1)卫星的太阳能电池帆板用先进的砷化镓主板和铝合金边框制成,铝合金的硬度比纯铝的 ________ (填“大”或“小”)。
(2)制造人造卫星常用到钛合金,由钛铁矿(主要成分是 FeO 和 TiO₂)提取金属钛的主要工艺流程如下图所示。

① 钛合金属于 ________ (填“金属材料”或“合成材料”)。
② 步骤Ⅰ中,FeO 与碳反应,其中体现还原性的是 ________ (填化学式)。
③ 步骤Ⅲ中发生反应的化学方程式为 ________ ,基本反应类型是 ________ 。
④ 从 MgCl₂溶液到 MgCl₂·6H₂O 晶体的过程是 ________ (填“物理”或“化学”)变化。
答案:
大@@金属材料@@C@@TiCl₄ + 2Mg $\stackrel{高温}{=\!=\!=}$ 2MgCl₂ + Ti@@置换反应@@化学@@【解析】(2)①钛合金属于金属材料。②在氧化亚铁与碳反应的过程中,碳得到了氧,发生了氧化反应,表现出还原性。③步骤Ⅲ中是四氯化钛与镁在高温条件下反应生成氯化镁和钛,该反应的化学方程式为TiCl₄ + 2Mg $\stackrel{高温}{=\!=\!=}$ 2MgCl₂ + Ti。④MgCl₂和MgCl₂·6H₂O是两种物质,从MgCl₂溶液到MgCl₂·6H₂O的过程发生了化学变化。
查看更多完整答案,请扫码查看


