第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
**例1** (2024·四川乐山节选)太阳能电池路灯(如右图所示),可以实现白天用太阳能充电,夜晚照明,其灯柱材料为铝合金,路灯内部采用金属铜作导线。回答下列问题。

(1)制作灯柱所需的铝合金属于 ________ (填“金属材料”或“合成材料”)。
(2)铝合金的硬度和强度都比纯铝 ________ (填“高”或“低”)。
(3)太阳能电池路灯使用铜作导线,是因为铜具有良好的 ________ 性。

(1)制作灯柱所需的铝合金属于 ________ (填“金属材料”或“合成材料”)。
(2)铝合金的硬度和强度都比纯铝 ________ (填“高”或“低”)。
(3)太阳能电池路灯使用铜作导线,是因为铜具有良好的 ________ 性。
答案:
金属材料@@高@@导电
1. **新素养 化学观念** 用金属的物理性质填空。
(1)油罐车的尾部经常有一条铁链拖到地上,这是利用了铁的 ________ 性。
(2)铁常用来制作炊具,这是利用了铁的延展性和 ________ 性。
(3)用金属钨制白炽灯的灯丝,这是利用了钨具有 ________ 的性质。
(4)小华很快从金属堆中识别出了铜,因为 ________________________ 。
(5)家庭电路中作保险丝的金属材料,除具有良好的导电性外,还一定要具有的物理性质是 ________ 。
(1)油罐车的尾部经常有一条铁链拖到地上,这是利用了铁的 ________ 性。
(2)铁常用来制作炊具,这是利用了铁的延展性和 ________ 性。
(3)用金属钨制白炽灯的灯丝,这是利用了钨具有 ________ 的性质。
(4)小华很快从金属堆中识别出了铜,因为 ________________________ 。
(5)家庭电路中作保险丝的金属材料,除具有良好的导电性外,还一定要具有的物理性质是 ________ 。
答案:
导电@@导热@@熔点高@@铜呈红色,其他金属多数呈银白色@@熔点低
**例2** (2024·福建厦门月考)订书钉的主要成分是铁,其表面镀有镁或锌中的一种。小组的同学取订书钉 5.6 g 放入图甲装置中,并在干燥管口用氢气传感器测量氢气的质量,同时记录电子天平显示的质量变化(如图乙所示),5.8 min 后各数据保持稳定不再变化。下列说法不正确的是 ( )
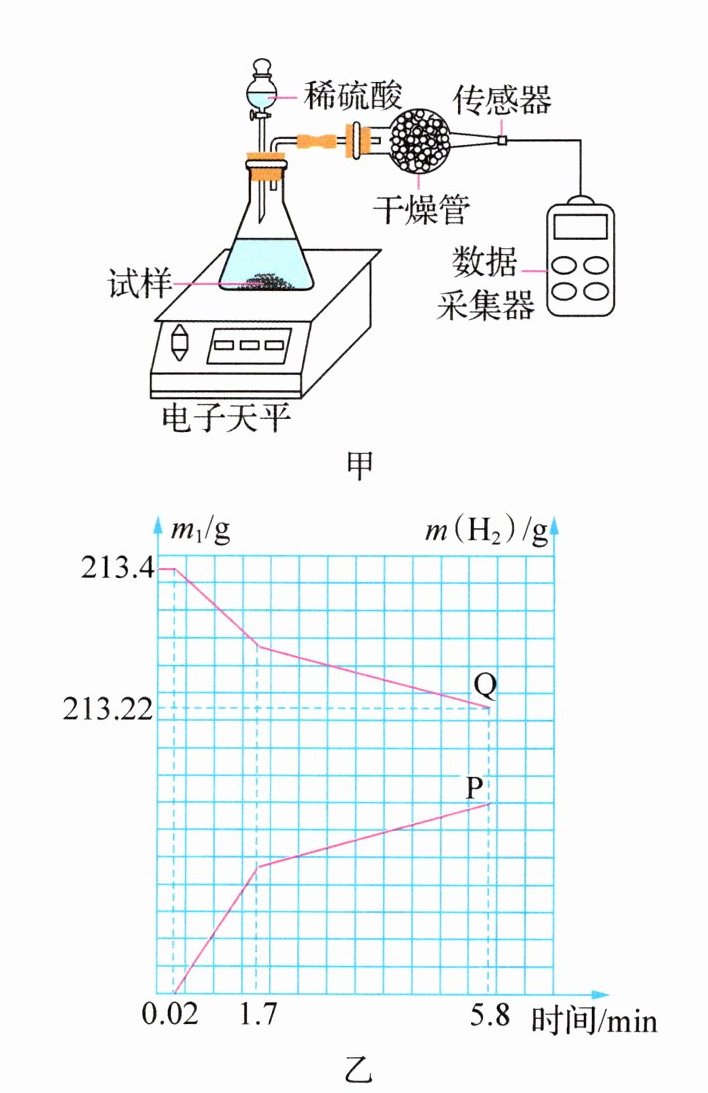
A. 曲线 Q 表示电子天平读数
B. 实验中应加入足量的稀硫酸,使金属完全反应
C. 1.7 min 后铁与稀硫酸开始反应
D. 通过所给数据分析,订书钉表面镀的金属是镁

A. 曲线 Q 表示电子天平读数
B. 实验中应加入足量的稀硫酸,使金属完全反应
C. 1.7 min 后铁与稀硫酸开始反应
D. 通过所给数据分析,订书钉表面镀的金属是镁
答案:
D【解析】随着反应的进行,不断生成氢气,氢气不断逸出,锥形瓶中物质的质量逐渐减小,电子天平的读数减小,所以曲线Q表示电子天平读数,故A正确;实验过程中应加入足量的稀硫酸,使金属完全反应,从而计算另一种物质是锌还是镁,故B正确;镁和锌的金属活动性均比铁的强,与酸反应的速率均比铁快,由题图乙可知,1.7 min后金属与酸反应的速率减慢,即镁或锌与酸完全反应,1.7 min后铁与稀硫酸开始反应,故C正确;由题图乙可知,5.6 g金属完全反应后生成氢气的质量为213.4 g - 213.22 g = 0.18 g,铁与硫酸反应的化学方程式为Fe + H₂SO₄ = FeSO₄ + H₂↑,5.6 g铁与硫酸完全反应生成氢气的质量为0.2 g,镁与硫酸反应的化学方程式为Mg + H₂SO₄ = MgSO₄ + H₂↑,5.6 g镁与硫酸完全反应生成氢气的质量大于0.2 g,锌与硫酸反应的化学方程式为Zn + H₂SO₄ = ZnSO₄ + H₂↑,5.6 g锌与硫酸完全反应生成氢气的质量小于0.2 g,由上述数据可知,订书钉表面镀的金属是锌,故D错误。
2. (2024·湖南永州模拟)将一定量的锌和金属 R 的混合粉末加入一定量的氯化铜溶液中,溶液质量的变化情况如右下图所示。下列说法正确的是 ( )
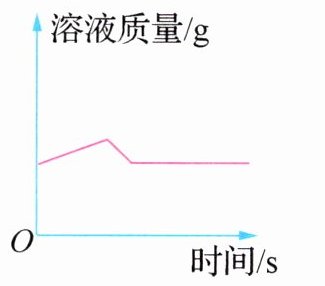
A. 金属活动性:Zn<R
B. 反应结束后过滤,滤渣中一定有 Cu,可能有 Zn 和 R
C. 反应结束后过滤,若向滤渣中加入稀硫酸有气泡产生,则滤液不一定呈无色
D. 某金属粉末含有 Zn、Al、Cu 中的一种或几种,取 6.5 g 该金属粉末与足量稀盐酸反应产生 0.2 g 氢气,则该金属粉末的组成有两种情况

A. 金属活动性:Zn<R
B. 反应结束后过滤,滤渣中一定有 Cu,可能有 Zn 和 R
C. 反应结束后过滤,若向滤渣中加入稀硫酸有气泡产生,则滤液不一定呈无色
D. 某金属粉末含有 Zn、Al、Cu 中的一种或几种,取 6.5 g 该金属粉末与足量稀盐酸反应产生 0.2 g 氢气,则该金属粉末的组成有两种情况
答案:
C【解析】根据反应的化学方程式Zn + CuCl₂ = ZnCl₂ + Cu可知,每65份质量的锌生成64份质量的铜,反应后固体质量减小,则反应后溶液质量增大,由题图可知,锌先与氯化铜反应,然后是R与氯化铜反应,说明金属活动性:Zn>R,故A错误。锌完全反应后,R才与氯化铜反应,则反应结束后过滤,滤渣中一定含有铜,一定不含锌,可能含有R,故B错误。反应结束后过滤,若向滤渣中加入稀硫酸有气泡产生,说明滤渣中含有R,且金属活动性:R>(H),若加入的R是铁,铁与氯化铜反应生成的氯化亚铁溶液是浅绿色的,故C正确。铜与盐酸不反应,设生成0.2 g氢气,消耗锌的质量为x,消耗铝的质量为y。
Zn + 2HCl = ZnCl₂ + H₂↑
65 2
x 0.2 g
$\frac{65}{2}=\frac{x}{0.2 g}$ ,x = 6.5 g
2Al + 6HCl = 2AlCl₃ + 3H₂↑
54 6
y 0.2 g
$\frac{54}{6}=\frac{y}{0.2 g}$ ,y = 1.8 g
则金属粉末组成有①锌;②锌、铝、铜;③铝、铜共三种情况,故D错误。
查看更多完整答案,请扫码查看


