第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
5. (2024·山东菏泽)生活在盐湖附近的人们习惯“冬天捞碱,夏天晒盐”,其中碱指的是$Na_2CO_3$,盐指的是$NaCl$,右下图为二者的溶解度曲线。下列有关说法正确的是 ( )
- A. 冬天捞的碱中混有少量$NaCl$,可以采用降温结晶的方法提纯$Na_2CO_3$
- B. $t\ ^{\circ}C$时,$Na_2CO_3$溶液和$NaCl$溶液中溶质的质量分数相同
- C. 冬天温度低,$NaCl$比$Na_2CO_3$更易从湖水中结晶析出
- D. 实现$NaCl$溶液由不饱和溶液到饱和溶液的转化,只能采用增加溶质的方法

- A. 冬天捞的碱中混有少量$NaCl$,可以采用降温结晶的方法提纯$Na_2CO_3$
- B. $t\ ^{\circ}C$时,$Na_2CO_3$溶液和$NaCl$溶液中溶质的质量分数相同
- C. 冬天温度低,$NaCl$比$Na_2CO_3$更易从湖水中结晶析出
- D. 实现$NaCl$溶液由不饱和溶液到饱和溶液的转化,只能采用增加溶质的方法

答案:
A
6. (2024·江苏扬州)《本草纲目》记载:“火药乃焰硝、硫磺、杉木炭所合……”焰硝经处理可得到含少量$NaCl$的$KNO_3$溶液,将其蒸发浓缩、冷却结晶、过滤,最终得到较纯净的$KNO_3$固体。$KNO_3$和$NaCl$的溶解度曲线如右下图所示。下列说法正确的是 ( )
A. $KNO_3$的溶解度大于$NaCl$的溶解度
B. “蒸发浓缩”是为了获得较高温度下$NaCl$的饱和溶液
C. $KNO_3$的溶解度随温度降低大幅减小,所以“冷却结晶”时析出$KNO_3$晶体
D. “过滤”所得滤液中的溶质只含有$NaCl$

A. $KNO_3$的溶解度大于$NaCl$的溶解度
B. “蒸发浓缩”是为了获得较高温度下$NaCl$的饱和溶液
C. $KNO_3$的溶解度随温度降低大幅减小,所以“冷却结晶”时析出$KNO_3$晶体
D. “过滤”所得滤液中的溶质只含有$NaCl$

答案:
C
7. (2024·内蒙古呼和浩特)$NaCl$在自然界分布很广,海水、盐湖、盐井和盐矿都是$NaCl$的来源。在地下千米左右的某盐矿储量巨大,$85\%$是$NaCl$,还含有少量$Na_2SO_4$等。结合物质的溶解性及$NaCl$和$Na_2SO_4$的溶解度曲线,回答下列问题。
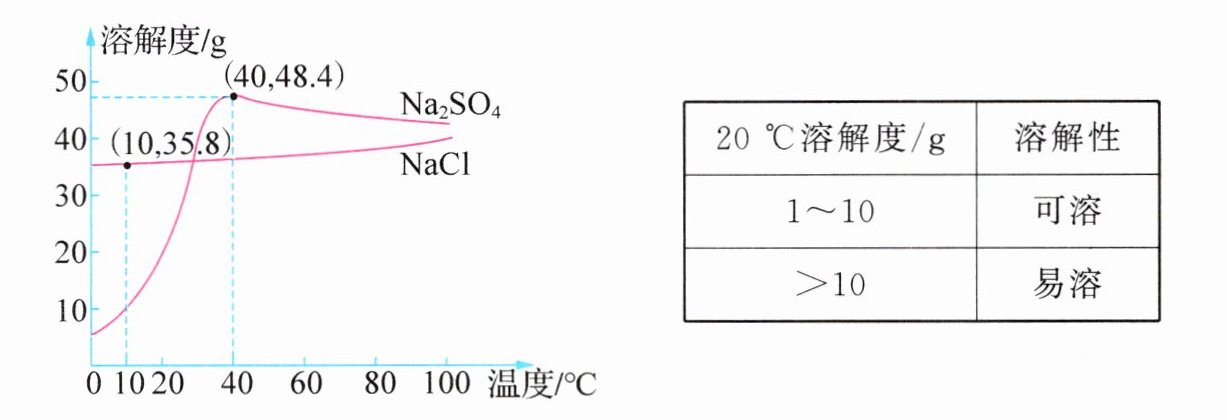
(1)$NaCl$属于_________(填“易溶”或“可溶”)物质。
(2)$10\ ^{\circ}C$时,$NaCl$饱和溶液中溶质的质量分数为__________________(列出计算式即可)。
(3)生产时,向盐矿中注水制成溶液,再通过管道输回地面。冬天地面温度低于地下温度,需要输回的溶液中$NaCl$的质量分数略低于地面其饱和溶液的溶质质量分数,否则易结晶导致管道堵塞(忽略管道中水分的损失),原因是____________________。
- (4)$Na_2SO_4$又称无水芒硝,是重要的化工原料。$40\ ^{\circ}C$时,输回地面的溶液分离出$NaCl$后,剩余溶液适宜采用_________的方法获得硫酸钠晶体,实现“盐硝联产”,增效环保。
[img id=7]

(1)$NaCl$属于_________(填“易溶”或“可溶”)物质。
(2)$10\ ^{\circ}C$时,$NaCl$饱和溶液中溶质的质量分数为__________________(列出计算式即可)。
(3)生产时,向盐矿中注水制成溶液,再通过管道输回地面。冬天地面温度低于地下温度,需要输回的溶液中$NaCl$的质量分数略低于地面其饱和溶液的溶质质量分数,否则易结晶导致管道堵塞(忽略管道中水分的损失),原因是____________________。
- (4)$Na_2SO_4$又称无水芒硝,是重要的化工原料。$40\ ^{\circ}C$时,输回地面的溶液分离出$NaCl$后,剩余溶液适宜采用_________的方法获得硫酸钠晶体,实现“盐硝联产”,增效环保。
[img id=7]
答案:
易溶@@$\frac{35.8\ g}{35.8\ g + 100\ g}×100\%$@@氯化钠溶解度随温度的降低而减小,降温后会从饱和溶液中析出@@降温结晶
8. (2024·江苏宿迁模拟)图$1$所示是$A$、$B$、$C$三种物质的溶解度曲线,下列说法正确的是 ( )
- A. $t_1\ ^{\circ}C$时,三种固体物质的溶解度最大的是$A$
- B. $t_2\ ^{\circ}C$时,将$30\ g\ A$放入$50\ g$水中,所得溶液的质量为$80\ g$
- C. $t_2\ ^{\circ}C$时,若将等质量的$A$、$B$、$C$三种物质配制成饱和溶液,需溶剂最多的物质是$C$
- D. $t_1\ ^{\circ}C$时,取等质量的$A$、$C$饱和溶液分别置于甲、乙两支试管中,如图$2$所示。在大烧杯中加入一定质量的氢氧化钠固体溶解后,$A$、$C$溶液的溶质质量分数的大小关系是$A = C$
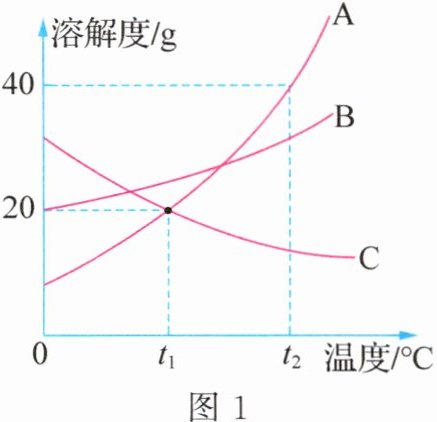
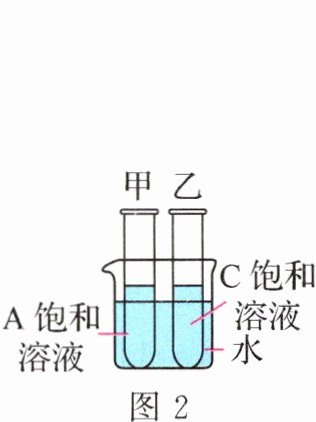
- A. $t_1\ ^{\circ}C$时,三种固体物质的溶解度最大的是$A$
- B. $t_2\ ^{\circ}C$时,将$30\ g\ A$放入$50\ g$水中,所得溶液的质量为$80\ g$
- C. $t_2\ ^{\circ}C$时,若将等质量的$A$、$B$、$C$三种物质配制成饱和溶液,需溶剂最多的物质是$C$
- D. $t_1\ ^{\circ}C$时,取等质量的$A$、$C$饱和溶液分别置于甲、乙两支试管中,如图$2$所示。在大烧杯中加入一定质量的氢氧化钠固体溶解后,$A$、$C$溶液的溶质质量分数的大小关系是$A = C$


答案:
C
查看更多完整答案,请扫码查看


