2025年教材帮高中化学选择性必修第二册鲁科版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学选择性必修第二册鲁科版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第82页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
例9 (高考组合)(1)[新情境·液态氟化氢的电离](2024上海卷)液态氟化氢(HF)的电离方式为:3HF⇌X+HF₂⁻,其中X为。HF₂⁻的结构为F—H…F⁻,其中F⁻与HF依靠相连接。
(2)(2023全国乙卷)已知一些物质的熔点数据如下表:
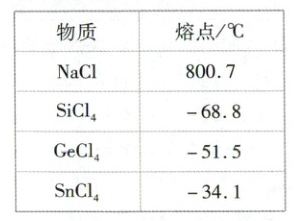
分析同族元素的氯化物SiCl₄、GeCl₄、SnCl₄熔点变化趋势及其原因。
(3)(全国甲卷改编)甲醇(CH₃OH)的沸点(64.7℃)介于水(100℃)和甲硫醇(CH₃SH,7.6℃)之间,其原因是。
(4)(全国卷改编)NH₃BH₃分子中,与N原子相连的H呈正电性(Hᵈ⁺),与B原子相连的H呈负电性(Hᵈ⁻),CH₃CH₃的熔点比NH₃BH₃(填“高”或“低”),原因是在NH₃BH₃分子之间存在,也称“双氢键”。
(2)(2023全国乙卷)已知一些物质的熔点数据如下表:

分析同族元素的氯化物SiCl₄、GeCl₄、SnCl₄熔点变化趋势及其原因。
(3)(全国甲卷改编)甲醇(CH₃OH)的沸点(64.7℃)介于水(100℃)和甲硫醇(CH₃SH,7.6℃)之间,其原因是。
(4)(全国卷改编)NH₃BH₃分子中,与N原子相连的H呈正电性(Hᵈ⁺),与B原子相连的H呈负电性(Hᵈ⁻),CH₃CH₃的熔点比NH₃BH₃(填“高”或“低”),原因是在NH₃BH₃分子之间存在,也称“双氢键”。
答案:
(1)H₂F⁺ 氢键
(2)SiCl₄、GeCl₄、SnCl₄的熔点依次升高,因为三者的组成和结构相似,相对分子质量依次增大,分子间作用力逐渐增强
(3)甲硫醇不能形成分子间氢键,而水和甲醇均能形成分子间氢键;且水中的氢键比甲醇中的氢键多
(4)低 Hᵈ⁺与Hᵈ⁻的静电引力
解析 (1)根据原子守恒、电荷守恒可知,X为H₂F⁺。HF₂⁻的结构为F—H…F⁻,其中F⁻与HF之间依靠氢键连接。(2)组成和结构相似的分子,相对分子质量越大,分子间作用力越强,熔点越高。(3)甲醇和水分子中存在电负性较大的O原子及与其相连的H原子,能形成分子间氢键,且水中氢键较多,而甲硫醇不能形成分子间氢键,故沸点:水>甲醇>甲硫醇。(4)带相反电荷的微粒能形成静电引力,NH₃BH₃分子间存在Hᵈ⁺与Hᵈ⁻的静电引力,也称为“双氢键”,“双氢键”使物质的熔点较高,而CH₃CH₃分子间不存在“双氢键”,熔点较低。
【新名词】“双氢键”可表示为M—Hᵈ⁻…Hᵈ⁺—X,其中X是F、O、N、Cl、S或C等电负性比H大的元素,M是B、Al、Be、Na或过渡金属W和Mo等电负性比H小的元素
答案 (1)H₂F⁺ 氢键 (2)SiCl₄、GeCl₄、SnCl₄的熔点依次升高,因为三者的组成和结构相似,相对分子质量依次增大,分子间作用力逐渐增强 (3)甲硫醇不能形成分子间氢键,而水和甲醇均能形成分子间氢键,且水中的氢键比甲醇中的氢键多 (4)低 Hᵈ⁺与Hᵈ⁻的静电引力

(1)H₂F⁺ 氢键
(2)SiCl₄、GeCl₄、SnCl₄的熔点依次升高,因为三者的组成和结构相似,相对分子质量依次增大,分子间作用力逐渐增强
(3)甲硫醇不能形成分子间氢键,而水和甲醇均能形成分子间氢键;且水中的氢键比甲醇中的氢键多
(4)低 Hᵈ⁺与Hᵈ⁻的静电引力
解析 (1)根据原子守恒、电荷守恒可知,X为H₂F⁺。HF₂⁻的结构为F—H…F⁻,其中F⁻与HF之间依靠氢键连接。(2)组成和结构相似的分子,相对分子质量越大,分子间作用力越强,熔点越高。(3)甲醇和水分子中存在电负性较大的O原子及与其相连的H原子,能形成分子间氢键,且水中氢键较多,而甲硫醇不能形成分子间氢键,故沸点:水>甲醇>甲硫醇。(4)带相反电荷的微粒能形成静电引力,NH₃BH₃分子间存在Hᵈ⁺与Hᵈ⁻的静电引力,也称为“双氢键”,“双氢键”使物质的熔点较高,而CH₃CH₃分子间不存在“双氢键”,熔点较低。
【新名词】“双氢键”可表示为M—Hᵈ⁻…Hᵈ⁺—X,其中X是F、O、N、Cl、S或C等电负性比H大的元素,M是B、Al、Be、Na或过渡金属W和Mo等电负性比H小的元素
答案 (1)H₂F⁺ 氢键 (2)SiCl₄、GeCl₄、SnCl₄的熔点依次升高,因为三者的组成和结构相似,相对分子质量依次增大,分子间作用力逐渐增强 (3)甲硫醇不能形成分子间氢键,而水和甲醇均能形成分子间氢键,且水中的氢键比甲醇中的氢键多 (4)低 Hᵈ⁺与Hᵈ⁻的静电引力

2. (2022天津卷)下列物质沸点的比较,正确的是
(
A.CH₄>C₂H₆
B.HF>HCl
C.H₂S>H₂Se
D.CH₃CHCH₃>CH₃CH₂CH₂CH₃
CH₃
(
B
)A.CH₄>C₂H₆
B.HF>HCl
C.H₂S>H₂Se
D.CH₃CHCH₃>CH₃CH₂CH₂CH₃
CH₃
答案:
2.B 甲烷和乙烷的组成和结构相似,相对分子质量越大,范德华力越大,沸点越高,因此沸点CH₄<C₂H₆,A项错误;HF存在分子间氢键,因此沸点HF>HCl,B项正确;H₂S、H₂Se的组成和结构相似,相对分子质量越大,范德华力越大,沸点越高,因此沸点H₂S<H₂Se,C项错误;含相同碳原子数的烷烃,支链越多,沸点越低,因此沸点CH₃CH(CH₃)₂<CH₃CH₂CH₂CH₃,D项错误。
3. (高考组合)(1)(山东卷)NH₃、PH₃、AsH₃的沸点由高到低的顺序为
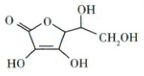
(2)(江苏卷)抗坏血酸的分子结构如图所示,推测抗坏血酸在水中的溶解性:
NH₃、AsH₃、PH₃
(填化学式)。(2)(江苏卷)抗坏血酸的分子结构如图所示,推测抗坏血酸在水中的溶解性:
易溶于水
(填“难溶于水”或“易溶于水”)。
答案:
3.
(1)NH₃、AsH₃、PH₃
(2)易溶于水
[解析]
(1)NH₃分子间存在氢键,导致其沸点比与N元素同主族的P、As元素的氢化物PH₃、AsH₃的沸点高,而影响PH₃、AsH₃的沸点的因素为范德华力,一般来说,分子结构和组成相似的物质,相对分子质量越大,范德华力越强,物质的沸点越高,则沸点由高到低的顺序为NH₃、AsH₃、PH₃。
(2)1个抗坏血酸分子中含有4个羟基,其可以与H₂O形成分子间氢键,所以抗坏血酸易溶于水。
(1)NH₃、AsH₃、PH₃
(2)易溶于水
[解析]
(1)NH₃分子间存在氢键,导致其沸点比与N元素同主族的P、As元素的氢化物PH₃、AsH₃的沸点高,而影响PH₃、AsH₃的沸点的因素为范德华力,一般来说,分子结构和组成相似的物质,相对分子质量越大,范德华力越强,物质的沸点越高,则沸点由高到低的顺序为NH₃、AsH₃、PH₃。
(2)1个抗坏血酸分子中含有4个羟基,其可以与H₂O形成分子间氢键,所以抗坏血酸易溶于水。
查看更多完整答案,请扫码查看


