2025年教材帮高中化学选择性必修第二册鲁科版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学选择性必修第二册鲁科版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第73页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
例14
${Cu^2+}$能与${NH3}$、${H2O}$、${OH-}$、${Cl-}$等形成配位数为4的配合物。
(1)向${CuSO4}$溶液中加入过量浓${NaOH}$溶液可生成${Na2[Cu(OH)4]}$。
${Na2[Cu(OH)4]}$中除配位键外,还存在的化学键有
A. 离子键
B. 金属键
C. 极性共价键
D. 非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:${Cu + H2O2 + 4NH3 = [Cu(NH3)4]^2+ + 2OH-}$。其原因是
(3)${Cu^2+}$可与乙二胺(${H2N-CH2-CH2-NH2}$,简写为en)形成配离子:
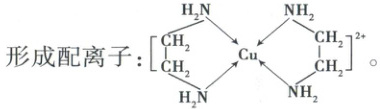
(图示内容:配离子结构简式,${Cu^2+}$为中心离子,与2个乙二胺分子中的4个${N}$原子形成配位键)
①该配离子的中心离子是
②乙二胺分子中${N}$原子成键时采取的杂化类型是
${Cu^2+}$能与${NH3}$、${H2O}$、${OH-}$、${Cl-}$等形成配位数为4的配合物。
(1)向${CuSO4}$溶液中加入过量浓${NaOH}$溶液可生成${Na2[Cu(OH)4]}$。
${Na2[Cu(OH)4]}$中除配位键外,还存在的化学键有
AC
(填标号)。A. 离子键
B. 金属键
C. 极性共价键
D. 非极性共价键
(2)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应:${Cu + H2O2 + 4NH3 = [Cu(NH3)4]^2+ + 2OH-}$。其原因是
过氧化氢为氧化剂,将${Cu}$氧化为${Cu^2+}$,${Cu^2+}$与氨分子形成配离子
。(3)${Cu^2+}$可与乙二胺(${H2N-CH2-CH2-NH2}$,简写为en)形成配离子:

(图示内容:配离子结构简式,${Cu^2+}$为中心离子,与2个乙二胺分子中的4个${N}$原子形成配位键)
①该配离子的中心离子是
${Cu^2+}$
,配位数为4
。②乙二胺分子中${N}$原子成键时采取的杂化类型是
${sp^3}$
。
答案:
(1)AC
(2)过氧化氢为氧化剂,将${Cu}$氧化为${Cu^2+}$,${Cu^2+}$与氨分子形成配离子
(3)①${Cu^2+}$ 4 ②${sp^3}$
(1)AC
(2)过氧化氢为氧化剂,将${Cu}$氧化为${Cu^2+}$,${Cu^2+}$与氨分子形成配离子
(3)①${Cu^2+}$ 4 ②${sp^3}$
1. (1)在${[Ni(NH3)6]^2+}$中${Ni^2+}$与${NH3}$之间形成的化学键称为
(2)${CaF2}$难溶于水,但可溶于含${Al^3+}$的溶液中,原因是
配位键
,提供孤电子对的成键原子是N
(填元素符号)。(2)${CaF2}$难溶于水,但可溶于含${Al^3+}$的溶液中,原因是
3CaF₂ + Al³⁺══3Ca²⁺ + [AlF₆]³⁻
(用离子方程式表示,已知${[AlF6]^3-}$在溶液中可稳定存在)。
答案:
1.
(1)配位键 N
(2)3CaF₂ + Al³⁺══3Ca²⁺ + [AlF₆]³⁻
(1)配位键 N
(2)3CaF₂ + Al³⁺══3Ca²⁺ + [AlF₆]³⁻
例15(高考组合)(1)(全国卷)$ ZnF_2$具有较高的熔点($872\ ^{\circ} C$),其化学键类型是
(2)(2023全国甲卷)酞菁和钴酞菁的分子结构如图所示。
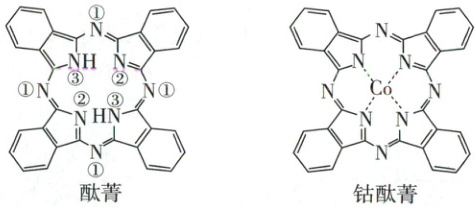
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是
离子键
;$ ZnF_2$不溶于有机溶剂而$ ZnCl_2$、$ ZnBr_2$、$ ZnI_2$能够溶于乙醇、乙醚等有机溶剂,原因是$ ZnF_2$为离子化合物,$ ZnCl_2$、$ ZnBr_2$、$ ZnI_2$的化学键以共价键为主、极性较小
。(2)(2023全国甲卷)酞菁和钴酞菁的分子结构如图所示。

酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是
③
(填酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为+2
,氮原子提供孤对电子与钴离子形成配位
键。
答案:
(1)离子键 $ ZnF_2$为离子化合物,$ ZnCl_2$、$ ZnBr_2$、$ ZnI_2$的化学键以共价键为主、极性较小
(2)③ +2 配位
解析▶
(1)根据$ ZnF_2$具有较高的熔点可知,$ ZnF_2$为离子化合物,含有离子键,而$ ZnCl_2$、$ ZnBr_2$、$ ZnI_2$的化学键以共价键为主、极性较小,故能够溶解在有机溶剂中。
(2)酞菁分子中所有原子共平面,由酞菁的结构可知,酞菁分子中间有一个空腔,由8个碳原子和8个氮原子围成,这个空腔存在一个18电子的大$\pi$键,其中两个—$ NH—$基团各提供两个p电子,其他的氮和碳各提供一个p电子,故p轨道能提供一对电子的N原子是③号N原子,钴酞菁分子中钴离子的化合价为+2,氮原子提供孤对电子与钴离子形成配位键。
答案▶
(1)离子键 $ ZnF_2$为离子化合物,$ ZnCl_2$、$ ZnBr_2$、$ ZnI_2$的化学键以共价键为主、极性较小
(2)③ +2 配位
(1)离子键 $ ZnF_2$为离子化合物,$ ZnCl_2$、$ ZnBr_2$、$ ZnI_2$的化学键以共价键为主、极性较小
(2)③ +2 配位
解析▶
(1)根据$ ZnF_2$具有较高的熔点可知,$ ZnF_2$为离子化合物,含有离子键,而$ ZnCl_2$、$ ZnBr_2$、$ ZnI_2$的化学键以共价键为主、极性较小,故能够溶解在有机溶剂中。
(2)酞菁分子中所有原子共平面,由酞菁的结构可知,酞菁分子中间有一个空腔,由8个碳原子和8个氮原子围成,这个空腔存在一个18电子的大$\pi$键,其中两个—$ NH—$基团各提供两个p电子,其他的氮和碳各提供一个p电子,故p轨道能提供一对电子的N原子是③号N原子,钴酞菁分子中钴离子的化合价为+2,氮原子提供孤对电子与钴离子形成配位键。
答案▶
(1)离子键 $ ZnF_2$为离子化合物,$ ZnCl_2$、$ ZnBr_2$、$ ZnI_2$的化学键以共价键为主、极性较小
(2)③ +2 配位
查看更多完整答案,请扫码查看


