2025年教材帮高中化学选择性必修第二册鲁科版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学选择性必修第二册鲁科版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第17页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
7. 回答下列问题:
(1)某元素的3p轨道上有1个未成对电子,该元素为
(2)某元素基态原子的价电子排布式为4s²4p⁴,它在周期表中的位置是
(3)某元素的激发态(不稳定状态)原子的电子排布式为1s²2s²2p⁶3s¹3p³,该元素基态原子的电子排布式为
(4)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素。该元素基态原子的价电子排布式为3d⁵4s¹,该元素的名称为
——答案见第151页
(1)某元素的3p轨道上有1个未成对电子,该元素为
Al或Cl
(用元素符号表示)。(2)某元素基态原子的价电子排布式为4s²4p⁴,它在周期表中的位置是
第4周期ⅥA族
,其最高正化合价是+6
。(3)某元素的激发态(不稳定状态)原子的电子排布式为1s²2s²2p⁶3s¹3p³,该元素基态原子的电子排布式为
$1s^22s^22p^63s^23p^2$(或[Ne]$3s^23p^2$)
。(4)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素。该元素基态原子的价电子排布式为3d⁵4s¹,该元素的名称为
铬
,它在元素周期表中位于d
区。——答案见第151页
答案:
7.
(1)Al或Cl
(2)第4周期ⅥA族 +6
(3)$1s^22s^22p^63s^23p^2$(或[Ne]$3s^23p^2$)
(4)铬 d
[解析]
(1)某元素的3p轨道上有1个未成对电子,其基态原子的价电子排布式为$3s^23p^1$或$3s^23p^5$,该元素为Al或Cl。
(2)某元素基态原子的价电子排布式为$4s^24p^4$,它在元素周期表中的位置是第4周期ⅥA族,其最高正化合价是+6。
(3)某元素的激发态(不稳定状态)原子的电子排布式为$1s^22s^22p^63s^13p^3$,根据能量最低原理,其基态原子中电子应先排满3s能级,故该元素基态原子的电子排布式为$1s^22s^22p^63s^23p^2$或[Ne]$3s^23p^2$。
(4)该元素基态原子的价电子排布式为$3d^54s^1$,故该元素位于第4周期ⅦB族,其元素名称为铬,它在元素周期表中位于d区。
(1)Al或Cl
(2)第4周期ⅥA族 +6
(3)$1s^22s^22p^63s^23p^2$(或[Ne]$3s^23p^2$)
(4)铬 d
[解析]
(1)某元素的3p轨道上有1个未成对电子,其基态原子的价电子排布式为$3s^23p^1$或$3s^23p^5$,该元素为Al或Cl。
(2)某元素基态原子的价电子排布式为$4s^24p^4$,它在元素周期表中的位置是第4周期ⅥA族,其最高正化合价是+6。
(3)某元素的激发态(不稳定状态)原子的电子排布式为$1s^22s^22p^63s^13p^3$,根据能量最低原理,其基态原子中电子应先排满3s能级,故该元素基态原子的电子排布式为$1s^22s^22p^63s^23p^2$或[Ne]$3s^23p^2$。
(4)该元素基态原子的价电子排布式为$3d^54s^1$,故该元素位于第4周期ⅦB族,其元素名称为铬,它在元素周期表中位于d区。
例15 (高考组合)按要求回答下列问题:
(1)[新情境·电子的自旋磁量子数](河北卷)KH₂PO₄晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH₂PO₄晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
①在KH₂PO₄的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。
②原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+$\frac{1}{2}$表示,与之相反的用-$\frac{1}{2}$表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为。
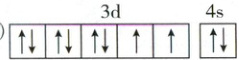
(2)(2024新课标卷)Ni基态原子价电子的轨道表示式为。
(3)(江苏卷)Cu²⁺基态核外电子排布式为。
(4)(全国卷)Zn原子核外电子排布式为。
(5)(2025广东卷)基态Ti原子的价层电子排布式为。
(6)(2025安徽卷)锶位于元素周期表第五周期第ⅡA族。基态锶原子价电子排布式为。
(1)[新情境·电子的自旋磁量子数](河北卷)KH₂PO₄晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH₂PO₄晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
①在KH₂PO₄的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。
②原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+$\frac{1}{2}$表示,与之相反的用-$\frac{1}{2}$表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为。
(2)(2024新课标卷)Ni基态原子价电子的轨道表示式为。
(3)(江苏卷)Cu²⁺基态核外电子排布式为。
(4)(全国卷)Zn原子核外电子排布式为。
(5)(2025广东卷)基态Ti原子的价层电子排布式为。
(6)(2025安徽卷)锶位于元素周期表第五周期第ⅡA族。基态锶原子价电子排布式为。
答案:
(1)①K⁺、P³⁻ ②+3/2(或-3/2);
(2)3d:↑↓ ↑↓ ↑↓ ↑ ↑ 4s:↑↓;
(3)[Ar]3d⁹(或1s²2s²2p⁶3s²3p⁶3d⁹);
(4)[Ar]3d¹⁰4s²(或1s²2s²2p⁶3s²3p⁶3d¹⁰4s²);
(5)3d²4s²;
(6)5s²
解析▶(1)①该物质中的四种元素形成的简单离子分别为K⁺、H⁺、P³⁻、O²⁻,分别有3、0、3、2个电子层,因此核外电子排布相同的是K⁺、P³⁻。②基态磷原子的价电子的轨道表示式为,3p能级的3个轨道上的电子自旋状态相同,故基态磷原子的价电子自旋磁量子数的代数和为+$\frac{3}{2}$或-$\frac{3}{2}$。
(2)Ni为28号元素,基态Ni原子的价电子排布式为3d⁸4s²,价电子的轨道表示式为。
(3)Cu²⁺的核外有27个电子,基态核外电子排布式为1s²2s²2p⁶3s²3p⁶3d⁹或[Ar]3d⁹。
(4)Zn原子核外有30个电子,其电子排布式为1s²2s²2p⁶3s²3p⁶3d¹⁰4s²或[Ar]3d¹⁰4s²。
(5)Ti是22号元素,位于元素周期表第4周期ⅣB族,故基态Ti原子的价层电子排布式是3d²4s²。
(6)Sr为第5周期ⅡA族元素,故其基态时的价电子排布式为5s²。
答案▶
(1)①K⁺、P³⁻ ②+$\frac{3}{2}$(或-$\frac{3}{2}$)
(2)
(3)1s²2s²2p⁶3s²3p⁶3d⁹(或[Ar]3d⁹)
(4)1s²2s²2p⁶3s²3p⁶3d¹⁰4s²(或[Ar]3d¹⁰4s²)
(5)3d²4s²
(6)5s²
(1)①K⁺、P³⁻ ②+3/2(或-3/2);
(2)3d:↑↓ ↑↓ ↑↓ ↑ ↑ 4s:↑↓;
(3)[Ar]3d⁹(或1s²2s²2p⁶3s²3p⁶3d⁹);
(4)[Ar]3d¹⁰4s²(或1s²2s²2p⁶3s²3p⁶3d¹⁰4s²);
(5)3d²4s²;
(6)5s²
解析▶(1)①该物质中的四种元素形成的简单离子分别为K⁺、H⁺、P³⁻、O²⁻,分别有3、0、3、2个电子层,因此核外电子排布相同的是K⁺、P³⁻。②基态磷原子的价电子的轨道表示式为,3p能级的3个轨道上的电子自旋状态相同,故基态磷原子的价电子自旋磁量子数的代数和为+$\frac{3}{2}$或-$\frac{3}{2}$。
(2)Ni为28号元素,基态Ni原子的价电子排布式为3d⁸4s²,价电子的轨道表示式为。
(3)Cu²⁺的核外有27个电子,基态核外电子排布式为1s²2s²2p⁶3s²3p⁶3d⁹或[Ar]3d⁹。
(4)Zn原子核外有30个电子,其电子排布式为1s²2s²2p⁶3s²3p⁶3d¹⁰4s²或[Ar]3d¹⁰4s²。
(5)Ti是22号元素,位于元素周期表第4周期ⅣB族,故基态Ti原子的价层电子排布式是3d²4s²。
(6)Sr为第5周期ⅡA族元素,故其基态时的价电子排布式为5s²。
答案▶
(1)①K⁺、P³⁻ ②+$\frac{3}{2}$(或-$\frac{3}{2}$)

(2)
(3)1s²2s²2p⁶3s²3p⁶3d⁹(或[Ar]3d⁹)
(4)1s²2s²2p⁶3s²3p⁶3d¹⁰4s²(或[Ar]3d¹⁰4s²)
(5)3d²4s²
(6)5s²
查看更多完整答案,请扫码查看


