2025年教材帮高中化学选择性必修第二册鲁科版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学选择性必修第二册鲁科版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
+ 例1-6 已知 $XY_2$ 分子属于角形分子,下列说法正确的是
【链高考】(2023 河北卷 6B) 若 $AB_2$ 型分子的空间构型相同,其中心原子的杂化方式也相同(✕)
A.X 原子一定是 $sp^2$ 杂化
B.X 原子一定是 $sp^3$ 杂化
C.X 原子上一定存在孤电子对
D.VSEPR 模型一定是平面三角形
【链高考】(2023 河北卷 6B) 若 $AB_2$ 型分子的空间构型相同,其中心原子的杂化方式也相同(✕)
A.X 原子一定是 $sp^2$ 杂化
B.X 原子一定是 $sp^3$ 杂化
C.X 原子上一定存在孤电子对
D.VSEPR 模型一定是平面三角形
答案:
C
解析 ▶ 一题多解 · 发散性思维
解法 1 理论分析法
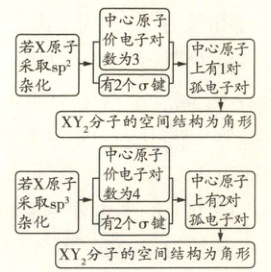
则 A、B 项错误,C 项正确。若 X 原子采取 $sp^2$ 杂化,则 VSEPR 模型是平面三角形;若 X 原子采取 $sp^3$ 杂化,则 VSEPR 模型为四面体形,D 项错误。
解法 2 列举实例法
若 $XY_2$ 为 $SO_2$,$SO_2$ 中 S 原子采取 $sp^2$ 杂化,S 原子上有 1 对孤电子对,其 VSEPR 模型为平面三角形,空间结构为角形,符合题意。若 $XY_2$ 为 $H_2O$,$H_2O$ 中 O 原子采取 $sp^3$ 杂化,O 原子上有 2 对孤电子对,其 VSEPR 模型为四面体形,空间结构为角形,符合题意。由以上分析可知,C 项正确。
答案 ▶ C
C
解析 ▶ 一题多解 · 发散性思维
解法 1 理论分析法

则 A、B 项错误,C 项正确。若 X 原子采取 $sp^2$ 杂化,则 VSEPR 模型是平面三角形;若 X 原子采取 $sp^3$ 杂化,则 VSEPR 模型为四面体形,D 项错误。
解法 2 列举实例法
若 $XY_2$ 为 $SO_2$,$SO_2$ 中 S 原子采取 $sp^2$ 杂化,S 原子上有 1 对孤电子对,其 VSEPR 模型为平面三角形,空间结构为角形,符合题意。若 $XY_2$ 为 $H_2O$,$H_2O$ 中 O 原子采取 $sp^3$ 杂化,O 原子上有 2 对孤电子对,其 VSEPR 模型为四面体形,空间结构为角形,符合题意。由以上分析可知,C 项正确。
答案 ▶ C
+ 例1-7 下列分子中,价电子对互斥模型与分子的空间结构相同的是
①$CH_2O$ ②$CO_2$ ③$NCl_3$ ④$H_2S$
A.①②
B.②③
C.③④
D.①④
①$CH_2O$ ②$CO_2$ ③$NCl_3$ ④$H_2S$
A.①②
B.②③
C.③④
D.①④
答案:
A
解析 ▶ 一题多解 · 发散性思维
价电子对互斥模型与分子的空间结构相同,说明分子的中心原子上的价电子对全部参与成键,无孤电子对。
解法 1 公式计算法
$CH_2O$ 中,C 原子上的孤电子对数为 $\frac{1}{2} × (4 - 1 × 2 - 2 × 1) = 0$;$CO_2$ 中,C 原子上的孤电子对数为 $\frac{1}{2} × (4 - 2 × 2) = 0$;
故 $CH_2O$ 和 $CO_2$ 的价电子对互斥模型与其分子的空间结构相同,A 项正确。
解法 2 结构分析法
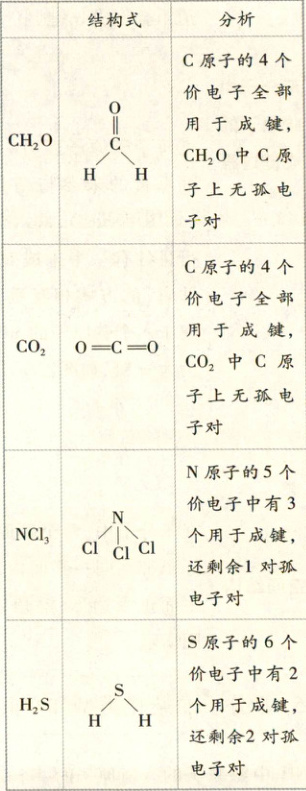
由上述分析可知 A 项正确。
答案 ▶ A
A
解析 ▶ 一题多解 · 发散性思维
价电子对互斥模型与分子的空间结构相同,说明分子的中心原子上的价电子对全部参与成键,无孤电子对。
解法 1 公式计算法
$CH_2O$ 中,C 原子上的孤电子对数为 $\frac{1}{2} × (4 - 1 × 2 - 2 × 1) = 0$;$CO_2$ 中,C 原子上的孤电子对数为 $\frac{1}{2} × (4 - 2 × 2) = 0$;
故 $CH_2O$ 和 $CO_2$ 的价电子对互斥模型与其分子的空间结构相同,A 项正确。
解法 2 结构分析法

由上述分析可知 A 项正确。
答案 ▶ A
查看更多完整答案,请扫码查看


