2025年教材帮高中化学选择性必修第二册鲁科版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学选择性必修第二册鲁科版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
例11 (2025江苏宿迁泗阳实验高级中学调研)已知短周期元素的离子ₐA²⁺、ᵦB⁺、cC³⁻、dD⁻具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C³⁻>D⁻>B⁺>A²⁺
D.单质的还原性:A>B>D>C
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C³⁻>D⁻>B⁺>A²⁺
D.单质的还原性:A>B>D>C
答案:
C
破题思路 具有相同的电子层结构是指核外电子排布完全相同,据此确定四种元素在元素周期表中的位置关系,利用元素周期律分析各选项。
解析 一题多解·发散性思维
本题既可以用相关规律判断,又可以用相应的具体元素来判断。
解法1 ₐA²⁺、ᵦB⁺、cC³⁻、dD⁻具有相同的电子层结构,则四种元素在元素周期表中的相对位置如图所示:

由此得出A、B、C、D的原子半径大小为B>A>C>D,A项错误;由A、B、C、D的相对位置,判断它们的原子序数大小为a>b>d>c,B项错误;根据“电子层结构相同的离子,原子序数越大,半径越小”来判断,C项正确;根据“同周期主族元素从左到右,元素还原性(金属性)逐渐减弱”来判断,D项错误。
解法2 找出相应的具体元素:₁₂Mg²⁺、₁₁Na⁺、₇N³⁻、₉F⁻,更容易作出判断。
答案 C
C
破题思路 具有相同的电子层结构是指核外电子排布完全相同,据此确定四种元素在元素周期表中的位置关系,利用元素周期律分析各选项。
解析 一题多解·发散性思维
本题既可以用相关规律判断,又可以用相应的具体元素来判断。
解法1 ₐA²⁺、ᵦB⁺、cC³⁻、dD⁻具有相同的电子层结构,则四种元素在元素周期表中的相对位置如图所示:

由此得出A、B、C、D的原子半径大小为B>A>C>D,A项错误;由A、B、C、D的相对位置,判断它们的原子序数大小为a>b>d>c,B项错误;根据“电子层结构相同的离子,原子序数越大,半径越小”来判断,C项正确;根据“同周期主族元素从左到右,元素还原性(金属性)逐渐减弱”来判断,D项错误。
解法2 找出相应的具体元素:₁₂Mg²⁺、₁₁Na⁺、₇N³⁻、₉F⁻,更容易作出判断。
答案 C
例12 (湖南长沙实验中学期末)如图所示是部分元素的第一电离能随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
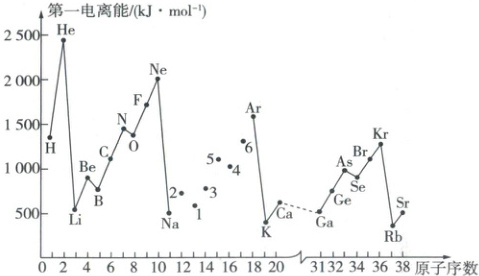
请回答下列问题:
(1)图中第一电离能最小的元素是,第一电离能最大的元素是。
(2)第3周期元素第一电离能由大到小的顺序为。
(3)同主族元素的第一电离能的变化规律是。
(4)Na~Ar元素中,某元素M的逐级电离能(单位:kJ·mol⁻¹)如表所示:

①由此判断该元素是(填元素符号)。
②分析图中同周期元素第一电离能的变化规律,推断I₁(Mg)(填“>”或“<”)I₁(M),其原因是。

请回答下列问题:
(1)图中第一电离能最小的元素是,第一电离能最大的元素是。
(2)第3周期元素第一电离能由大到小的顺序为。
(3)同主族元素的第一电离能的变化规律是。
(4)Na~Ar元素中,某元素M的逐级电离能(单位:kJ·mol⁻¹)如表所示:

①由此判断该元素是(填元素符号)。
②分析图中同周期元素第一电离能的变化规律,推断I₁(Mg)(填“>”或“<”)I₁(M),其原因是。
答案:
(1)Rb He
(2)Ar>Cl>P>S>Si>Mg>Al>Na
(3)同主族元素从上到下,元素的第一电离能逐渐减小
(4)①Al ②> 相比于Al,Mg的3p轨道为全空状态,比较稳定(或Al的第一电离能失去的电子是3p能级的,该能级电子的能量比Mg失去的3s能级电子的高)
解析
(1)一般,元素金属性越强,越容易失去电子,元素的第一电离能越小,则题图中第一电离能最小的元素是Rb;每个周期中稀有气体元素的第一电离能最大,0族元素从上到下,第一电离能逐渐减小,则题图中第一电离能最大的元素是He。
(2)同周期元素从左到右,第一电离能总体呈增大趋势,但第ⅡA族和第ⅤA族元素的第一电离能均比与它左右相邻的两种元素的大,则Mg、P的第一电离能分别比Al、S的第一电离能大。
(3)同主族元素从上到下,元素金属性逐渐增强,失电子能力增强,所以同主族元素的第一电离能的变化规律是从上到下逐渐减小。
(4)①从题表中的数据可知,该元素的第四电离能发生突变,说明该元素易失去3个电子,在Na~Ar元素中只有Al满足条件,即元素M是Al。②基态Mg原子的价电子排布式为3s²,基态Al原子的价电子排布式为3s²3p¹,Mg的3p轨道为全空状态,比较稳定(或Al的第一电离能失去的电子是3p能级的,该能级电子的能量比左边Mg失去的3s能级电子的高),则I₁(Mg)>I₁(Al)。
能量越高,越不稳定,更容易失去
答案
(1)Rb He
(2)Ar>Cl>P>S>Si>Mg>Al>Na
(3)同主族元素从上到下,元素的第一电离能逐渐减小
(4)①Al ②> 相比于Al,Mg的3p轨道为全空状态,比较稳定(或Al的第一电离能失去的电子是3p能级的,该能级电子的能量比左边Mg失去的3s能级电子的高;答案合理即可)
(1)Rb He
(2)Ar>Cl>P>S>Si>Mg>Al>Na
(3)同主族元素从上到下,元素的第一电离能逐渐减小
(4)①Al ②> 相比于Al,Mg的3p轨道为全空状态,比较稳定(或Al的第一电离能失去的电子是3p能级的,该能级电子的能量比Mg失去的3s能级电子的高)
解析
(1)一般,元素金属性越强,越容易失去电子,元素的第一电离能越小,则题图中第一电离能最小的元素是Rb;每个周期中稀有气体元素的第一电离能最大,0族元素从上到下,第一电离能逐渐减小,则题图中第一电离能最大的元素是He。
(2)同周期元素从左到右,第一电离能总体呈增大趋势,但第ⅡA族和第ⅤA族元素的第一电离能均比与它左右相邻的两种元素的大,则Mg、P的第一电离能分别比Al、S的第一电离能大。
(3)同主族元素从上到下,元素金属性逐渐增强,失电子能力增强,所以同主族元素的第一电离能的变化规律是从上到下逐渐减小。
(4)①从题表中的数据可知,该元素的第四电离能发生突变,说明该元素易失去3个电子,在Na~Ar元素中只有Al满足条件,即元素M是Al。②基态Mg原子的价电子排布式为3s²,基态Al原子的价电子排布式为3s²3p¹,Mg的3p轨道为全空状态,比较稳定(或Al的第一电离能失去的电子是3p能级的,该能级电子的能量比左边Mg失去的3s能级电子的高),则I₁(Mg)>I₁(Al)。
能量越高,越不稳定,更容易失去
答案
(1)Rb He
(2)Ar>Cl>P>S>Si>Mg>Al>Na
(3)同主族元素从上到下,元素的第一电离能逐渐减小
(4)①Al ②> 相比于Al,Mg的3p轨道为全空状态,比较稳定(或Al的第一电离能失去的电子是3p能级的,该能级电子的能量比左边Mg失去的3s能级电子的高;答案合理即可)
查看更多完整答案,请扫码查看


