2025年教材帮高中化学选择性必修第二册鲁科版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年教材帮高中化学选择性必修第二册鲁科版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
例 20(高考组合)(1)(2024 年 1 月浙江卷改编)$ NO_{3}^{-}$ 和 $ SO_{3}^{2-}$ 的空间结构分别为、。
(2)(河北卷)已知 $ KH_{2} PO_{2}$ 是次磷酸的正盐,$ H_{3} PO_{2}$ 的结构式为,其中 $ P$ 采取杂化方式。
(3)(湖南卷)$0^{\ \circ} C$ 时,气态 $ SiF_{4}$ 分子的空间结构是 ______ ;$ N$ - 甲基咪唑分子( )中碳原子的杂化轨道类型为 ______ 。
)中碳原子的杂化轨道类型为 ______ 。
(4)(2025 山东卷)尿素分子($ H_{2} NCONH_{2}$)中,$ C$ 原子采取的轨道杂化方式为。
(5)(2024 年 1 月浙江卷)$ H_{2} N—NH_{2}+ H^{+}\longrightarrow H_{2} N—NH_{3}^{+}$,其中 $— NH_{2}$ 的 $ N$ 原子杂化方式为;比较键角 $∠ HNH$:$ H_{2} N—NH_{2}$ 中的 $— NH_{2}$$ H_{2} N—NH_{3}^{+}$ 中 $— NH_{3}^{+}$(填“$>$”“$<$”或“$=$”),请说明理由。
(2)(河北卷)已知 $ KH_{2} PO_{2}$ 是次磷酸的正盐,$ H_{3} PO_{2}$ 的结构式为,其中 $ P$ 采取杂化方式。
(3)(湖南卷)$0^{\ \circ} C$ 时,气态 $ SiF_{4}$ 分子的空间结构是 ______ ;$ N$ - 甲基咪唑分子(
 )中碳原子的杂化轨道类型为 ______ 。
)中碳原子的杂化轨道类型为 ______ 。(4)(2025 山东卷)尿素分子($ H_{2} NCONH_{2}$)中,$ C$ 原子采取的轨道杂化方式为。
(5)(2024 年 1 月浙江卷)$ H_{2} N—NH_{2}+ H^{+}\longrightarrow H_{2} N—NH_{3}^{+}$,其中 $— NH_{2}$ 的 $ N$ 原子杂化方式为;比较键角 $∠ HNH$:$ H_{2} N—NH_{2}$ 中的 $— NH_{2}$$ H_{2} N—NH_{3}^{+}$ 中 $— NH_{3}^{+}$(填“$>$”“$<$”或“$=$”),请说明理由。
答案:
(1)平面三角形 三角锥形
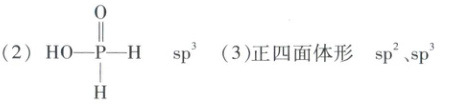
(2)$ HO—P—H$ $ sp^{3}$
(3)正四面体形 $ sp^{2}$、$ sp^{3}$
(4)$ sp^{2}$
(5)$ sp^{3}$ $<$ $— NH_{2}$ 中 $ N$ 有孤电子对,对成键电子对的斥力大,键角小
解析 ▶︎
(1)$ NO_{3}^{-}$ 的中心原子 $ N$ 的孤电子对数 $=\frac{5 + 1 - 3×2}{2}=0$,为 $ sp^{2}$ 杂化,则 $ NO_{3}^{-}$ 的空间结构为平面三角形。$ SO_{3}^{2-}$ 的中心原子 $ S$ 的孤电子对数 $=\frac{6 + 2 - 3×2}{2}=1$,为 $ sp^{3}$ 杂化,则 $ SO_{3}^{2-}$ 的空间结构为三角锥形。
(2)$ KH_{2} PO_{2}$ 是次磷酸的正盐,则 $ H_{3} PO_{2}$ 为一元酸,$ H_{3} PO_{2}$ 中含有 $1$ 个羟基,其结构式为 $ HO—\begin{matrix} O\\ ||\\ P\\ |\\ H\end{matrix}$,$ P$ 形成 $4$ 个 $\sigma$ 键,无孤电子对,故杂化类型为 $ sp^{3}$。
(3)$ SiF_{4}$ 分子的中心原子 $ Si$ 的价电子对数为 $4+\frac{4 - 4×1}{2}=4$,无孤电子对,根据价电子对互斥理论,可判断该分子的空间结构为正四面体形。根据杂化轨道理论可分析出 $ N$ - 甲基咪唑分子中碳原子的杂化轨道类型为 $ sp^{2}$ 和 $ sp^{3}$。
(4)尿素分子中,$ C$ 原子形成 $1$ 个双键、$2$ 个单键,无孤电子对,故 $ C$ 原子采取的轨道杂化方式为 $ sp^{2}$。
(5)$— NH_{2}$ 中 $ N$ 原子的价电子对数为 $3+\frac{5 - 1×3}{2}=4$,故杂化方式为 $ sp^{3}$;$— NH_{2}$ 的价电子对数为 $4$,有 $1$ 对孤电子对,$— NH_{3}^{+}$ 的价电子对数为 $4+\frac{5 - 1 - 1×4}{2}=4$,无孤电子对,由孤电子对对成键电子对的斥力大于成键电子对对成键电子对的斥力,键角 $∠ HNH$:$— NH_{2}$ 中 $ N$ 有孤电子对,对成键电子对的斥力大,键角小
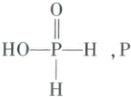
答案 ▶︎
(1)平面三角形 三角锥形
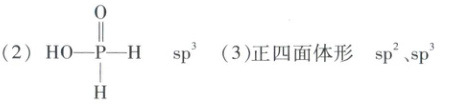
(2)$ HO—P—H$ $ sp^{3}$
(3)正四面体形 $ sp^{2}$、$ sp^{3}$
(4)$ sp^{2}$
(5)$ sp^{3}$ $<$ $— NH_{2}$ 中 $ N$ 有孤电子对,对成键电子对的斥力大,键角小
(1)平面三角形 三角锥形
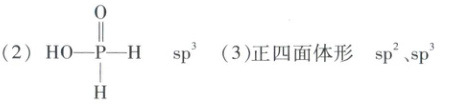
(2)$ HO—P—H$ $ sp^{3}$
(3)正四面体形 $ sp^{2}$、$ sp^{3}$
(4)$ sp^{2}$
(5)$ sp^{3}$ $<$ $— NH_{2}$ 中 $ N$ 有孤电子对,对成键电子对的斥力大,键角小
解析 ▶︎
(1)$ NO_{3}^{-}$ 的中心原子 $ N$ 的孤电子对数 $=\frac{5 + 1 - 3×2}{2}=0$,为 $ sp^{2}$ 杂化,则 $ NO_{3}^{-}$ 的空间结构为平面三角形。$ SO_{3}^{2-}$ 的中心原子 $ S$ 的孤电子对数 $=\frac{6 + 2 - 3×2}{2}=1$,为 $ sp^{3}$ 杂化,则 $ SO_{3}^{2-}$ 的空间结构为三角锥形。
(2)$ KH_{2} PO_{2}$ 是次磷酸的正盐,则 $ H_{3} PO_{2}$ 为一元酸,$ H_{3} PO_{2}$ 中含有 $1$ 个羟基,其结构式为 $ HO—\begin{matrix} O\\ ||\\ P\\ |\\ H\end{matrix}$,$ P$ 形成 $4$ 个 $\sigma$ 键,无孤电子对,故杂化类型为 $ sp^{3}$。
(3)$ SiF_{4}$ 分子的中心原子 $ Si$ 的价电子对数为 $4+\frac{4 - 4×1}{2}=4$,无孤电子对,根据价电子对互斥理论,可判断该分子的空间结构为正四面体形。根据杂化轨道理论可分析出 $ N$ - 甲基咪唑分子中碳原子的杂化轨道类型为 $ sp^{2}$ 和 $ sp^{3}$。
(4)尿素分子中,$ C$ 原子形成 $1$ 个双键、$2$ 个单键,无孤电子对,故 $ C$ 原子采取的轨道杂化方式为 $ sp^{2}$。
(5)$— NH_{2}$ 中 $ N$ 原子的价电子对数为 $3+\frac{5 - 1×3}{2}=4$,故杂化方式为 $ sp^{3}$;$— NH_{2}$ 的价电子对数为 $4$,有 $1$ 对孤电子对,$— NH_{3}^{+}$ 的价电子对数为 $4+\frac{5 - 1 - 1×4}{2}=4$,无孤电子对,由孤电子对对成键电子对的斥力大于成键电子对对成键电子对的斥力,键角 $∠ HNH$:$— NH_{2}$ 中 $ N$ 有孤电子对,对成键电子对的斥力大,键角小

答案 ▶︎
(1)平面三角形 三角锥形
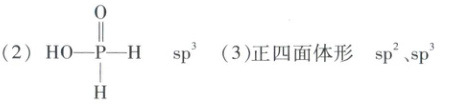
(2)$ HO—P—H$ $ sp^{3}$
(3)正四面体形 $ sp^{2}$、$ sp^{3}$
(4)$ sp^{2}$
(5)$ sp^{3}$ $<$ $— NH_{2}$ 中 $ N$ 有孤电子对,对成键电子对的斥力大,键角小
例 21(2025 黑吉辽蒙卷) 可用于水的杀菌消毒,遇水发生反应:。下列说法正确的是
A.反应中各分子的 键均为 键
B.反应中各分子的 VSEPR 模型均为四面体形
C. 键长小于 键长
D. 分子中 的价电子层有 个孤电子对
A.反应中各分子的 键均为 键
B.反应中各分子的 VSEPR 模型均为四面体形
C. 键长小于 键长
D. 分子中 的价电子层有 个孤电子对
答案:
B
解析 ▶︎ 水分子中的 $ H—O\ \sigma$ 键和 $ HClO$ 中的 $ H—O\ \sigma$ 键均为 $ s-p\ \sigma$ 键,A 项错误;$ Cl_{2} O$ 中 $ O$ 的价电子对数为 $2+\frac{6 - 2×1}{2}=4$,$ H_{2} O$ 中 $ O$ 的价电子对数为 $2+\frac{6 - 2×1}{2}=4$,$ HClO$ 中 $ O$ 的价电子对数为 $2+\frac{6 - 2×1}{2}=4$,故反应中各分子的 VSEPR 模型均为四面体形,B 项正确;原子半径:$ H< Cl$,故 $ Cl—O$ 键长大于 $ H—O$ 键长,C 项错误;$ HClO$ 的电子式为 $ H\begin{matrix} :O:\\ ..\ ..\end{matrix} Cl:$,故 $ Cl$ 的价电子层有 $3$ 个孤电子对,D 项错误。
答案 ▶︎ B
解析 ▶︎ 水分子中的 $ H—O\ \sigma$ 键和 $ HClO$ 中的 $ H—O\ \sigma$ 键均为 $ s-p\ \sigma$ 键,A 项错误;$ Cl_{2} O$ 中 $ O$ 的价电子对数为 $2+\frac{6 - 2×1}{2}=4$,$ H_{2} O$ 中 $ O$ 的价电子对数为 $2+\frac{6 - 2×1}{2}=4$,$ HClO$ 中 $ O$ 的价电子对数为 $2+\frac{6 - 2×1}{2}=4$,故反应中各分子的 VSEPR 模型均为四面体形,B 项正确;原子半径:$ H< Cl$,故 $ Cl—O$ 键长大于 $ H—O$ 键长,C 项错误;$ HClO$ 的电子式为 $ H\begin{matrix} :O:\\ ..\ ..\end{matrix} Cl:$,故 $ Cl$ 的价电子层有 $3$ 个孤电子对,D 项错误。
答案 ▶︎ B
查看更多完整答案,请扫码查看


