第132页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
18.(10分)(2025·南昌模拟)劳动能提升生活技能。周末,小明向妈妈学习烹饪技术,调味时用到氯化钠。返校后,小明和化学兴趣小组的同学对“海水晒盐”到制成食盐的过程产生了浓厚的兴趣,于是进行了项目式探究。
任务一:实验室模拟古法晒盐过程并除去粗盐中的不溶性杂质。
【查阅资料】浙江象山“海水晒盐”——古法晒盐技艺入选国家级非物质文化遗产名录。象山晒盐以海水为基本原料,通过日晒、风力蒸发等方法,盐结晶成了原盐,留下了卤水。
(1)下列除去粗盐中不溶性杂质的实验操作中,类似“海水晒盐”原理的是(填字母)。
A. 溶解
B. 蒸发
C. 过滤
D. 搅拌
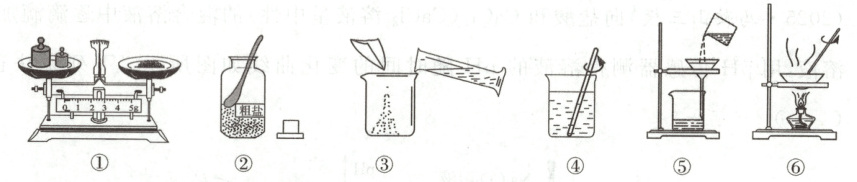
(2)下图是小明除去粗盐中不溶性杂质的实验操作过程。按实验操作考试评分标准评价,1个错误操作扣1分,小明被扣2分,他的错误操作是(填序号)。
任务二:检验粗盐中可溶性杂质的成分。
【资料与说明】①将粗盐除去泥沙等不溶性杂质后,溶液可能还含有CaCl₂、MgCl₂、Na₂SO₄等可溶性杂质;②Ca(OH)₂、CaSO₄微溶于水;③本实验探究中微溶物不沉淀。
【实验探究】
(3)小明向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明不含杂质。
【继续探究】
(4)兴趣小组其他同学继续进行以下探究:
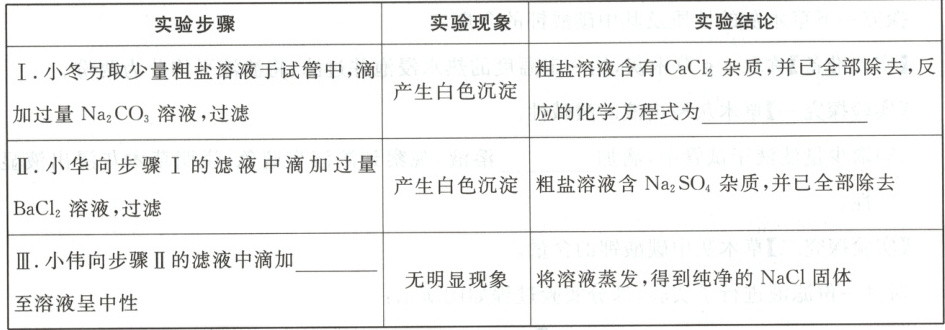
【得出结论】粗盐中可溶性杂质成分已确定,且已完全除去。
【交流讨论】
(5)同学们讨论之后,认为步骤Ⅱ无法得出粗盐溶液含有Na₂SO₄杂质的结论,理由是。
【反思评价】
(6)若实验过程中不考虑损耗,最终得到NaCl固体的质量将(填“大于”“小于”或“等于”)粗盐溶液中NaCl固体的质量。
任务一:实验室模拟古法晒盐过程并除去粗盐中的不溶性杂质。
【查阅资料】浙江象山“海水晒盐”——古法晒盐技艺入选国家级非物质文化遗产名录。象山晒盐以海水为基本原料,通过日晒、风力蒸发等方法,盐结晶成了原盐,留下了卤水。
(1)下列除去粗盐中不溶性杂质的实验操作中,类似“海水晒盐”原理的是(填字母)。
A. 溶解
B. 蒸发
C. 过滤
D. 搅拌
(2)下图是小明除去粗盐中不溶性杂质的实验操作过程。按实验操作考试评分标准评价,1个错误操作扣1分,小明被扣2分,他的错误操作是(填序号)。

任务二:检验粗盐中可溶性杂质的成分。
【资料与说明】①将粗盐除去泥沙等不溶性杂质后,溶液可能还含有CaCl₂、MgCl₂、Na₂SO₄等可溶性杂质;②Ca(OH)₂、CaSO₄微溶于水;③本实验探究中微溶物不沉淀。
【实验探究】
(3)小明向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明不含杂质。
【继续探究】
(4)兴趣小组其他同学继续进行以下探究:

【得出结论】粗盐中可溶性杂质成分已确定,且已完全除去。
【交流讨论】
(5)同学们讨论之后,认为步骤Ⅱ无法得出粗盐溶液含有Na₂SO₄杂质的结论,理由是。
【反思评价】
(6)若实验过程中不考虑损耗,最终得到NaCl固体的质量将(填“大于”“小于”或“等于”)粗盐溶液中NaCl固体的质量。
答案:
(1)B
(2)①⑤
(3)MgCl₂
(4)Na₂CO₃ + CaCl₂ = CaCO₃↓ + 2NaCl;稀盐酸(或HCl溶液)
(5)步骤Ⅰ中加入的过量Na₂CO₃与BaCl₂反应也会生成白色沉淀BaCO₃,无法确定沉淀是否来自Na₂SO₄
(6)大于
解析:
(1)“海水晒盐”通过蒸发水分使盐结晶,与蒸发操作原理相同,选B。
(2)错误操作:①天平称量时“左码右物”(应左物右码);⑤过滤时未用玻璃棒引流,共2处错误,扣2分。
(3)NaOH与MgCl₂反应生成Mg(OH)₂沉淀,无现象说明不含MgCl₂。
(4)Na₂CO₃与CaCl₂反应生成CaCO₃沉淀和NaCl;步骤Ⅲ需用稀盐酸除去过量的Na₂CO₃和BaCl₂,至溶液中性。
(5)步骤Ⅰ中过量的Na₂CO₃与BaCl₂反应生成BaCO₃沉淀,干扰Na₂SO₄的检验。
(6)除杂反应(如Na₂CO₃+CaCl₂)生成NaCl,导致最终NaCl质量大于原粗盐中的NaCl质量。
(1)B
(2)①⑤
(3)MgCl₂
(4)Na₂CO₃ + CaCl₂ = CaCO₃↓ + 2NaCl;稀盐酸(或HCl溶液)
(5)步骤Ⅰ中加入的过量Na₂CO₃与BaCl₂反应也会生成白色沉淀BaCO₃,无法确定沉淀是否来自Na₂SO₄
(6)大于
解析:
(1)“海水晒盐”通过蒸发水分使盐结晶,与蒸发操作原理相同,选B。
(2)错误操作:①天平称量时“左码右物”(应左物右码);⑤过滤时未用玻璃棒引流,共2处错误,扣2分。
(3)NaOH与MgCl₂反应生成Mg(OH)₂沉淀,无现象说明不含MgCl₂。
(4)Na₂CO₃与CaCl₂反应生成CaCO₃沉淀和NaCl;步骤Ⅲ需用稀盐酸除去过量的Na₂CO₃和BaCl₂,至溶液中性。
(5)步骤Ⅰ中过量的Na₂CO₃与BaCl₂反应生成BaCO₃沉淀,干扰Na₂SO₄的检验。
(6)除杂反应(如Na₂CO₃+CaCl₂)生成NaCl,导致最终NaCl质量大于原粗盐中的NaCl质量。
查看更多完整答案,请扫码查看


