第36页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
7. 做完二氧化碳的制取和性质实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。某同学处理废液时做了如下实验:取废液缸中上层清液 $40mL$ 于烧杯中,逐滴滴入 $Na_{2}CO_{3}$ 溶液至过量。记录滴入 $Na_{2}CO_{3}$ 溶液质量($x$)与有关量的变化关系如图所示。下列判断不正确的是(
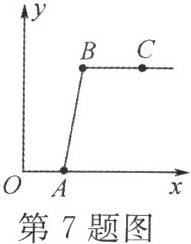
A.$C$ 点溶液的 $pH>7$
B.图中纵坐标($y$)表示生成沉淀的质量
C.反应进行到 $B$ 点时,溶液中的溶质是 $NaCl$
D.$OA$ 段发生反应的化学方程式是 $Na_{2}CO_{3}+CaCl_{2}=2NaCl+CaCO_{3}\downarrow$
D
)
A.$C$ 点溶液的 $pH>7$
B.图中纵坐标($y$)表示生成沉淀的质量
C.反应进行到 $B$ 点时,溶液中的溶质是 $NaCl$
D.$OA$ 段发生反应的化学方程式是 $Na_{2}CO_{3}+CaCl_{2}=2NaCl+CaCO_{3}\downarrow$
答案:
D
8. 为鉴别硫酸铵、硝酸铵、硝酸钠三种无色溶液,将它们随机编号为 $A$、$B$、$C$,实验过程及现象如图所示:
(1)$A$ 中的溶质是
(2)$B$ 与硝酸钡溶液混合:
①反应的化学方程式为________________________;
②过滤,分别列出滤液中所含溶质的所有可能情况:________________________。

(1)$A$ 中的溶质是
NH₄NO₃;NH₄NO₃和(NH₄)₂SO₄;NH₄NO₃和Ba(NO₃)₂
。(2)$B$ 与硝酸钡溶液混合:
①反应的化学方程式为________________________;
②过滤,分别列出滤液中所含溶质的所有可能情况:________________________。

答案:
(1)NaNO₃;(2)①(NH₄)₂SO₄+Ba(NO₃)₂=BaSO₄↓+2NH₄NO₃;②NH₄NO₃;NH₄NO₃和(NH₄)₂SO₄;NH₄NO₃和Ba(NO₃)₂
9. 小科在实验室用铜片与浓硫酸制备硫酸铜溶液,以下是他收集到的一些资料:
资料一:实验室用铜片与浓硫酸制备硫酸铜溶液时,往往会产生有污染的 $SO_{2}$ 气体,随着硫酸浓度变小,反应会停止,使得硫酸利用率比较低。
资料二:实际生产中,往往将铜片在空气中加热,使其氧化生成 $CuO$,再溶解在稀硫酸中,即可得到硫酸铜溶液;这一过程的缺点是铜片表面加热易被氧化,而包裹在里面的铜得不到氧化。
资料三:工业上对此进行了改进,可以在浸入硫酸中的铜片表面不断通 $O_{2}$,并加热;也可以在硫酸和铜的混合容器中滴加 $H_{2}O_{2}$ 溶液。
资料四:制取时需趁热过滤。
请回答下列问题:
(1)小科在制备硫酸铜溶液时,将制得的 $CuSO_{4}$ 溶液倒入另一蒸发皿中加热浓缩直至有晶膜出现(铜有剩余),冷却析出的晶体中含有白色粉末,试解释其原因:________________________。
(2)若按资料三进行制备,请写出 $Cu$ 在 $H_{2}O_{2}$ 作用下与稀硫酸反应的化学方程式:
资料一:实验室用铜片与浓硫酸制备硫酸铜溶液时,往往会产生有污染的 $SO_{2}$ 气体,随着硫酸浓度变小,反应会停止,使得硫酸利用率比较低。
资料二:实际生产中,往往将铜片在空气中加热,使其氧化生成 $CuO$,再溶解在稀硫酸中,即可得到硫酸铜溶液;这一过程的缺点是铜片表面加热易被氧化,而包裹在里面的铜得不到氧化。
资料三:工业上对此进行了改进,可以在浸入硫酸中的铜片表面不断通 $O_{2}$,并加热;也可以在硫酸和铜的混合容器中滴加 $H_{2}O_{2}$ 溶液。
资料四:制取时需趁热过滤。
请回答下列问题:
(1)小科在制备硫酸铜溶液时,将制得的 $CuSO_{4}$ 溶液倒入另一蒸发皿中加热浓缩直至有晶膜出现(铜有剩余),冷却析出的晶体中含有白色粉末,试解释其原因:________________________。
(2)若按资料三进行制备,请写出 $Cu$ 在 $H_{2}O_{2}$ 作用下与稀硫酸反应的化学方程式:
Cu + H₂O₂ + H₂SO₄ = CuSO₄ + 2H₂O
。
答案:
(1)加热浓缩使硫酸浓度升高,其吸水性导致部分硫酸铜晶体失去结晶水生成无水硫酸铜(白色粉末);(2)Cu + H₂O₂ + H₂SO₄ = CuSO₄ + 2H₂O
10. 科学小组用如图所示装置研究酸、碱、盐的性质(夹持仪器已省略)。
(1)关闭 $K_{2}$,打开 $K_{1}$ 和分液漏斗玻璃塞、活塞,向 $B$ 装置中加入稀盐酸,使其浸没大理石后关闭分液漏斗活塞。$A$ 中反应的化学方程式为
(2)当 $B$ 中的物质仍在反应时,关闭 $K_{1}$,打开 $K_{2}$。一段时间后 $C$ 中的现象为
(1)关闭 $K_{2}$,打开 $K_{1}$ 和分液漏斗玻璃塞、活塞,向 $B$ 装置中加入稀盐酸,使其浸没大理石后关闭分液漏斗活塞。$A$ 中反应的化学方程式为
$CO_2 + Ca(OH)_2 \rightarrow CaCO_3 \downarrow + H_2O$
,$B$ 中发生反应的化学方程式为$CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2 \uparrow$
。(2)当 $B$ 中的物质仍在反应时,关闭 $K_{1}$,打开 $K_{2}$。一段时间后 $C$ 中的现象为
有白色沉淀生成
;充分反应后,$C$ 中一定含有溶质 $NaCl$ 的原因是B 中反应生成的 $CaCl_2$ 与 C 中过量的 $Na_2CO_3$ 反应生成 $NaCl$
。
答案:
(1)$CO_2 + Ca(OH)_2 \rightarrow CaCO_3 \downarrow + H_2O$;$CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2 \uparrow$
(2)有白色沉淀生成;B 中反应生成的 $CaCl_2$ 与 C 中过量的 $Na_2CO_3$ 反应生成 $NaCl$。
(2)有白色沉淀生成;B 中反应生成的 $CaCl_2$ 与 C 中过量的 $Na_2CO_3$ 反应生成 $NaCl$。
查看更多完整答案,请扫码查看


