第85页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
(1)此过程中产生CO的质量是
(2)计算此炉甘石中${ZnCO_{3}}$的质量分数。
解:设此炉甘石中ZnCO₃的质量为x。
ZnCO₃+2C$\frac{\underline{\text{高温}}}{}$Zn+3CO↑
125 84
x 84 kg
$\frac{125}{84}$=$\frac{x}{84\,\text{kg}}$
x=125 kg
此炉甘石中ZnCO₃的质量分数为$\frac{125\,\text{kg}}{200\,\text{kg}}$×100%=62.5%
答:此炉甘石中ZnCO₃的质量分数为62.5%。
84
kg。(2)计算此炉甘石中${ZnCO_{3}}$的质量分数。
解:设此炉甘石中ZnCO₃的质量为x。
ZnCO₃+2C$\frac{\underline{\text{高温}}}{}$Zn+3CO↑
125 84
x 84 kg
$\frac{125}{84}$=$\frac{x}{84\,\text{kg}}$
x=125 kg
此炉甘石中ZnCO₃的质量分数为$\frac{125\,\text{kg}}{200\,\text{kg}}$×100%=62.5%
答:此炉甘石中ZnCO₃的质量分数为62.5%。
答案:
4.
(1)84
(2)解:设此炉甘石中ZnCO₃的质量为x。ZnCO₃+2C$\frac{\underline{\text{高温}}}{}$Zn+3CO↑ 125 84 x 84 kg $\frac{125}{84}$=$\frac{x}{84\,\text{kg}}$ x=125 kg 此炉甘石中ZnCO₃的质量分数为$\frac{125\,\text{kg}}{200\,\text{kg}}$×100%=62.5% 答:此炉甘石中ZnCO₃的质量分数为62.5%。
(1)84
(2)解:设此炉甘石中ZnCO₃的质量为x。ZnCO₃+2C$\frac{\underline{\text{高温}}}{}$Zn+3CO↑ 125 84 x 84 kg $\frac{125}{84}$=$\frac{x}{84\,\text{kg}}$ x=125 kg 此炉甘石中ZnCO₃的质量分数为$\frac{125\,\text{kg}}{200\,\text{kg}}$×100%=62.5% 答:此炉甘石中ZnCO₃的质量分数为62.5%。
5 小明取25.0g过氧化氢溶液放入烧杯中,然后进行如图所示的实验。请计算:
(1)反应后产生气体的质量为
(2)此过氧化氢溶液中过氧化氢的质量。
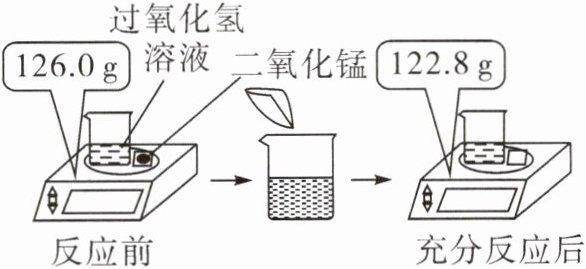
(1)反应后产生气体的质量为
3.2
g。(2)此过氧化氢溶液中过氧化氢的质量。

解:设过氧化氢的质量为x。2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑ 68 32 x 3.2 g $\frac{68}{32}$=$\frac{x}{3.2\,\text{g}}$ x=6.8 g 答:此过氧化氢溶液中过氧化氢的质量为6.8 g。
答案:
5.
(1)3.2
(2)解:设过氧化氢的质量为x。2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑ 68 32 x 3.2 g $\frac{68}{32}$=$\frac{x}{3.2\,\text{g}}$ x=6.8 g 答:此过氧化氢溶液中过氧化氢的质量为6.8 g。
(1)3.2
(2)解:设过氧化氢的质量为x。2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑ 68 32 x 3.2 g $\frac{68}{32}$=$\frac{x}{3.2\,\text{g}}$ x=6.8 g 答:此过氧化氢溶液中过氧化氢的质量为6.8 g。
Ⅰ. 探究反应原理
(1)某品牌制氧机的制氧剂为过碳酸钠和二氧化锰。已知过碳酸钠溶于水产生过氧化氢和碳酸钠。小组同学用图示实验装置探究是否有氧气生成。
观察到甲试管中有小气泡缓慢冒出,木条不复燃;乙试管中小气泡快速冒出,木条复燃。
①实验结论:有氧气生成且
②写出乙试管中生成气体的化学方程式:
Ⅱ. 制作反应装置
(2)学习小组的同学自己设计并制作了制氧机,如图所示。反应仓是氧气产生的场所。加湿过滤仓不能起到的作用是
Ⅲ. 选择合适供氧剂
(3)过氧化钙(${CaO_{2}}$)和过氧化钠(${Na_{2}O_{2}}$)均可作供氧剂。过氧化钙与水反应生成对应的氢氧化钙和氧气,过氧化钠与过氧化钙的化学性质相似。10g过氧化钠固体和10g过氧化钙固体与足量水作用生成氧气的质量与时间的关系如图所示。
(3)为了解决鱼的吸氧问题,给鱼缸缓慢持续供氧,应选的供氧剂为
(4)请计算10g过氧化钙完全反应时产生氧气的质量(写出计算过程,结果精确到0.01)。
解:设10 g过氧化钙完全反应时产生氧气的质量为x。
2CaO₂+2H₂O=2Ca(OH)₂+O₂↑
144 32
10 g x
$\frac{32}{144}$=$\frac{x}{10\,\text{g}}$
x≈2.22 g
答:10 g过氧化钙完全反应时产生氧气的质量为2.22 g。
(1)某品牌制氧机的制氧剂为过碳酸钠和二氧化锰。已知过碳酸钠溶于水产生过氧化氢和碳酸钠。小组同学用图示实验装置探究是否有氧气生成。
观察到甲试管中有小气泡缓慢冒出,木条不复燃;乙试管中小气泡快速冒出,木条复燃。
①实验结论:有氧气生成且
二氧化锰能加快过氧化氢的分解
。②写出乙试管中生成气体的化学方程式:
2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑
。Ⅱ. 制作反应装置
(2)学习小组的同学自己设计并制作了制氧机,如图所示。反应仓是氧气产生的场所。加湿过滤仓不能起到的作用是
D
(填字母)。Ⅲ. 选择合适供氧剂
(3)过氧化钙(${CaO_{2}}$)和过氧化钠(${Na_{2}O_{2}}$)均可作供氧剂。过氧化钙与水反应生成对应的氢氧化钙和氧气,过氧化钠与过氧化钙的化学性质相似。10g过氧化钠固体和10g过氧化钙固体与足量水作用生成氧气的质量与时间的关系如图所示。
(3)为了解决鱼的吸氧问题,给鱼缸缓慢持续供氧,应选的供氧剂为
过氧化钙
。(4)请计算10g过氧化钙完全反应时产生氧气的质量(写出计算过程,结果精确到0.01)。
解:设10 g过氧化钙完全反应时产生氧气的质量为x。
2CaO₂+2H₂O=2Ca(OH)₂+O₂↑
144 32
10 g x
$\frac{32}{144}$=$\frac{x}{10\,\text{g}}$
x≈2.22 g
答:10 g过氧化钙完全反应时产生氧气的质量为2.22 g。
答案:
6.
(1)①二氧化锰能加快过氧化氢的分解 ②2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑
(2)D
(3)过氧化钙
(4)解:设10 g过氧化钙完全反应时产生氧气的质量为x。2CaO₂+2H₂O=2Ca(OH)₂+O₂↑ 144 32 10 g x $\frac{32}{144}$=$\frac{x}{10\,\text{g}}$ x≈2.22 g 答:10 g过氧化钙完全反应时产生氧气的质量为2.22 g。
(1)①二氧化锰能加快过氧化氢的分解 ②2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑
(2)D
(3)过氧化钙
(4)解:设10 g过氧化钙完全反应时产生氧气的质量为x。2CaO₂+2H₂O=2Ca(OH)₂+O₂↑ 144 32 10 g x $\frac{32}{144}$=$\frac{x}{10\,\text{g}}$ x≈2.22 g 答:10 g过氧化钙完全反应时产生氧气的质量为2.22 g。
查看更多完整答案,请扫码查看


