第47页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
(1)锆元素在元素周期表中位于第
(2)①与锆元素的化学性质相似的为
②若 M²⁻与氖原子核外电子排布完全相同,则 M 元素的名称是
五
周期,锆原子核内质子数为40
。(2)①与锆元素的化学性质相似的为
A
(填字母)。所对应元素在元素周期表中的位置是②
(填序号),这两种原子要达到稳定结构需失去
(填“得到”或“失去”)电子。②若 M²⁻与氖原子核外电子排布完全相同,则 M 元素的名称是
氧
。已知 M 原子的相对原子质量为 a,则 M 原子核内的中子数约为a−8
。
答案:
(1)五 40
(2)①A ② 失去 ②氧 a−8 [解析]
(1)锆元素原子核外电子层数为5层,在元素周期表中位于第五周期,锆原子核内质子数为40。
(2)①在原子中,质子数=核外电子数,则x=12−2−8=2,最外层电子数决定原子的化学性质,故A与锆元素的化学性质相似;A原子的质子数是12,应该排在钠(11号元素)之后,则A所对应元素在元素周期表中的位置是②;这两种原子最外层电子数均为2,容易失去2个电子达到稳定结构,形成阳离子。②氖原子的核外电子数是10,M²⁻与氖原子核外电子排布完全相同,则M的质子数为10−2=8,故M元素的名称是氧元素;已知M原子的相对原子质量为a,相对原子质量≈质子数+中子数,氧原子的质子数是8,则M原子核内的中子数约为a−8。
(1)五 40
(2)①A ② 失去 ②氧 a−8 [解析]
(1)锆元素原子核外电子层数为5层,在元素周期表中位于第五周期,锆原子核内质子数为40。
(2)①在原子中,质子数=核外电子数,则x=12−2−8=2,最外层电子数决定原子的化学性质,故A与锆元素的化学性质相似;A原子的质子数是12,应该排在钠(11号元素)之后,则A所对应元素在元素周期表中的位置是②;这两种原子最外层电子数均为2,容易失去2个电子达到稳定结构,形成阳离子。②氖原子的核外电子数是10,M²⁻与氖原子核外电子排布完全相同,则M的质子数为10−2=8,故M元素的名称是氧元素;已知M原子的相对原子质量为a,相对原子质量≈质子数+中子数,氧原子的质子数是8,则M原子核内的中子数约为a−8。
8 中考新考法 同位素拓展科普阅读下面的科普短文并回答问题。
研究发现,同种元素的原子核中,中子数不一定相同,如氢元素的原子核(如下表)。

为了更好地区别同种元素的不同原子,常用原子符号_{Z}^{A}X 来表示质量数为A、质子数为Z的X原子,其中质量数= 质子数+中子数。如上述氕、氘、氚 3 种不同的氢原子就可以依次表示为_{1}^{1}H、_{1}^{2}H、_{1}^{3}H。
质子数相同而中子数不同的同一元素的不同原子互称为同位素,如_{1}^{1}H、_{1}^{2}H 和_{1}^{3}H 互为同位素。同位素在生活、生产和科学研究中有着重要作用,例如考古时利用_{6}^{14}C 测定一些文物的年代;通过测定_{6}^{13}C 和_{7}^{15}N,分析古代人类的食物结构;追踪_{15}^{35}P 发出的射线,确定磷在植物中的作用部位等。
(1)测定相对原子质量时,要使用含有 6 个质子和 6 个中子的一种碳原子质量的$\frac{1}{12}$作标准。该碳原子的原子符号为____。
(2)在_{3}^{6}Li、_{3}^{7}Li、_{11}^{23}Na、_{12}^{24}Mg、_{6}^{14}C、_{7}^{14}N 中,互为同位素的是____和____。
(3)_{15}^{35}P 的原子核内中子数是____。
(4)下列说法正确的是____(填字母)。
A._{8}^{16}O 原子的结构示意图为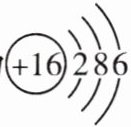
B. 氘原子与氚原子的相对原子质量一定不同
C. 由_{1}^{2}H 和_{8}^{18}O 组成的 1 个水分子中含 11 个中子
D. 氕、氘、氚 3 种氢原子最多可以组成 6 种不同的氢分子
(5)元素周期表中第 8 号元素是地壳中含量最多的元素,该元素是____(填元素名称)。
(6)镁元素位于元素周期表中的第____周期第____A 族。
研究发现,同种元素的原子核中,中子数不一定相同,如氢元素的原子核(如下表)。

为了更好地区别同种元素的不同原子,常用原子符号_{Z}^{A}X 来表示质量数为A、质子数为Z的X原子,其中质量数= 质子数+中子数。如上述氕、氘、氚 3 种不同的氢原子就可以依次表示为_{1}^{1}H、_{1}^{2}H、_{1}^{3}H。
质子数相同而中子数不同的同一元素的不同原子互称为同位素,如_{1}^{1}H、_{1}^{2}H 和_{1}^{3}H 互为同位素。同位素在生活、生产和科学研究中有着重要作用,例如考古时利用_{6}^{14}C 测定一些文物的年代;通过测定_{6}^{13}C 和_{7}^{15}N,分析古代人类的食物结构;追踪_{15}^{35}P 发出的射线,确定磷在植物中的作用部位等。
(1)测定相对原子质量时,要使用含有 6 个质子和 6 个中子的一种碳原子质量的$\frac{1}{12}$作标准。该碳原子的原子符号为____。
(2)在_{3}^{6}Li、_{3}^{7}Li、_{11}^{23}Na、_{12}^{24}Mg、_{6}^{14}C、_{7}^{14}N 中,互为同位素的是____和____。
(3)_{15}^{35}P 的原子核内中子数是____。
(4)下列说法正确的是____(填字母)。
A._{8}^{16}O 原子的结构示意图为

B. 氘原子与氚原子的相对原子质量一定不同
C. 由_{1}^{2}H 和_{8}^{18}O 组成的 1 个水分子中含 11 个中子
D. 氕、氘、氚 3 种氢原子最多可以组成 6 种不同的氢分子
(5)元素周期表中第 8 号元素是地壳中含量最多的元素,该元素是____(填元素名称)。
(6)镁元素位于元素周期表中的第____周期第____A 族。
答案:
(1)₆¹²C
(2)₃⁶Li ₃⁷Li
(3)20
(4)BD
(5)氧
(6)三 ⅡA
[解析]
(1)质量数=质子数+中子数,含有6个质子和6个中子的碳原子的质量数等于12,该碳原子的原子符号为₆¹²C。
(2)质子数相同而中子数不同的同一元素的不同原子互称为同位素,互为同位素的是₃⁶Li和₃⁷Li。
(3)质量数=质子数+中子数,故₁₅³⁵P的中子数是35−15=20。
(4)₈¹⁸O的质子数为8,故原子的结构示意图 ,A错误;氘原子与氚原子的质子数相同,中子数不同,相对原子质量不同,B正确;¹²H的中子数为2−1=1,₈¹⁸O的中子数为18−8=10,2个氢原子和1个氧原子构成1个水分子,故1个该水分子中含有12个中子,C错误;氕(H)、氘(D)、氚(T)3种氢原子最多可以组成6种不同的氢分子:H₂、D₂、T₂、HD、HT、DT,D正确。
,A错误;氘原子与氚原子的质子数相同,中子数不同,相对原子质量不同,B正确;¹²H的中子数为2−1=1,₈¹⁸O的中子数为18−8=10,2个氢原子和1个氧原子构成1个水分子,故1个该水分子中含有12个中子,C错误;氕(H)、氘(D)、氚(T)3种氢原子最多可以组成6种不同的氢分子:H₂、D₂、T₂、HD、HT、DT,D正确。
(5)8号元素为氧元素,地壳中含量最高的元素是氧元素。
(6)镁元素的原子中含有12个质子,核外有三个电子层,最外层电子数是2,则镁元素位于元素周期表中的第三周期第ⅡA族。
(1)₆¹²C
(2)₃⁶Li ₃⁷Li
(3)20
(4)BD
(5)氧
(6)三 ⅡA
[解析]
(1)质量数=质子数+中子数,含有6个质子和6个中子的碳原子的质量数等于12,该碳原子的原子符号为₆¹²C。
(2)质子数相同而中子数不同的同一元素的不同原子互称为同位素,互为同位素的是₃⁶Li和₃⁷Li。
(3)质量数=质子数+中子数,故₁₅³⁵P的中子数是35−15=20。
(4)₈¹⁸O的质子数为8,故原子的结构示意图
 ,A错误;氘原子与氚原子的质子数相同,中子数不同,相对原子质量不同,B正确;¹²H的中子数为2−1=1,₈¹⁸O的中子数为18−8=10,2个氢原子和1个氧原子构成1个水分子,故1个该水分子中含有12个中子,C错误;氕(H)、氘(D)、氚(T)3种氢原子最多可以组成6种不同的氢分子:H₂、D₂、T₂、HD、HT、DT,D正确。
,A错误;氘原子与氚原子的质子数相同,中子数不同,相对原子质量不同,B正确;¹²H的中子数为2−1=1,₈¹⁸O的中子数为18−8=10,2个氢原子和1个氧原子构成1个水分子,故1个该水分子中含有12个中子,C错误;氕(H)、氘(D)、氚(T)3种氢原子最多可以组成6种不同的氢分子:H₂、D₂、T₂、HD、HT、DT,D正确。(5)8号元素为氧元素,地壳中含量最高的元素是氧元素。
(6)镁元素的原子中含有12个质子,核外有三个电子层,最外层电子数是2,则镁元素位于元素周期表中的第三周期第ⅡA族。
查看更多完整答案,请扫码查看


