第84页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
1 新情境 碳中和 (2023·吉林中考改编)“碳中和”指力争实现二氧化碳的排放量等于二氧化碳的吸收量。二氧化碳的吸收方式有“自然吸收”和“人工转化”。
(1)“自然吸收”的途径之一是“海水吸收”,其涉及的原理包括水与二氧化碳发生反应生成碳酸(${H_{2}CO_{3}}$),其化学方程式为
(2)“人工转化”的方法之一是指二氧化碳转化为优质的燃料甲醇(${CH_{3}OH}$),请完成其化学方程式的配平。
${}$
(3)计算要得到32t甲醇,理论上可以吸收多少吨二氧化碳?(写出计算过程)
解:设理论上可以吸收二氧化碳的质量为x。
CO₂+3H₂$\frac{\underline{\text{催化剂}}}{}$CH₃OH+H₂O
44 32
x 32 t
$\frac{44}{32}$=$\frac{x}{32\,\text{t}}$
x=44 t
答:要得到32 t甲醇,理论上可以吸收二氧化碳的质量为44 t。
(1)“自然吸收”的途径之一是“海水吸收”,其涉及的原理包括水与二氧化碳发生反应生成碳酸(${H_{2}CO_{3}}$),其化学方程式为
CO₂+H₂O=H₂CO₃
。(2)“人工转化”的方法之一是指二氧化碳转化为优质的燃料甲醇(${CH_{3}OH}$),请完成其化学方程式的配平。
${}$
1
${CO_{2} + }$3
${H_{2}\xlongequal{催化剂}}$1
${CH_{3}OH + }$1
${H_{2}O}$(3)计算要得到32t甲醇,理论上可以吸收多少吨二氧化碳?(写出计算过程)
解:设理论上可以吸收二氧化碳的质量为x。
CO₂+3H₂$\frac{\underline{\text{催化剂}}}{}$CH₃OH+H₂O
44 32
x 32 t
$\frac{44}{32}$=$\frac{x}{32\,\text{t}}$
x=44 t
答:要得到32 t甲醇,理论上可以吸收二氧化碳的质量为44 t。
答案:
1.
(1)CO₂+H₂O=H₂CO₃
(2)1 3 1 1
(3)解:设理论上可以吸收二氧化碳的质量为x。CO₂+3H₂$\frac{\underline{\text{催化剂}}}{}$CH₃OH+H₂O 44 32 x 32 t $\frac{44}{32}$=$\frac{x}{32\,\text{t}}$ x=44 t 答:要得到32 t甲醇,理论上可以吸收二氧化碳的质量为44 t。
(1)CO₂+H₂O=H₂CO₃
(2)1 3 1 1
(3)解:设理论上可以吸收二氧化碳的质量为x。CO₂+3H₂$\frac{\underline{\text{催化剂}}}{}$CH₃OH+H₂O 44 32 x 32 t $\frac{44}{32}$=$\frac{x}{32\,\text{t}}$ x=44 t 答:要得到32 t甲醇,理论上可以吸收二氧化碳的质量为44 t。
(1)10g该石灰石样品与稀盐酸恰好完全反应时,消耗的稀盐酸的总质量是
(2)该样品中碳酸钙的质量分数为多少?(写出计算过程)
(3)这种测定方法产生误差的原因可能是
30
g,产生二氧化碳的总质量是2.64
g。(2)该样品中碳酸钙的质量分数为多少?(写出计算过程)
解:设该样品中碳酸钙的质量为x。CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 44 x 2.64g $\frac{100}{44}$=$\frac{x}{2.64\,\text{g}}$ x=6 g 该样品中碳酸钙的质量分数为$\frac{6\,\text{g}}{10\,\text{g}}$×100%=60% 答:该样品中碳酸钙的质量分数为60%。
(3)这种测定方法产生误差的原因可能是
有少部分二氧化碳溶于水
(写1条)。
答案:
2.
(1)30 2.64
(2)解:设该样品中碳酸钙的质量为x。CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 44 x 2.64g $\frac{100}{44}$=$\frac{x}{2.64\,\text{g}}$ x=6 g 该样品中碳酸钙的质量分数为$\frac{6\,\text{g}}{10\,\text{g}}$×100%=60% 答:该样品中碳酸钙的质量分数为60%。
(3)有少部分二氧化碳溶于水
(1)30 2.64
(2)解:设该样品中碳酸钙的质量为x。CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑ 100 44 x 2.64g $\frac{100}{44}$=$\frac{x}{2.64\,\text{g}}$ x=6 g 该样品中碳酸钙的质量分数为$\frac{6\,\text{g}}{10\,\text{g}}$×100%=60% 答:该样品中碳酸钙的质量分数为60%。
(3)有少部分二氧化碳溶于水
3 化学兴趣小组的同学用一瓶过氧化氢溶液制取氧气,并用来探究氧气的性质。他们取用68g过氧化氢溶液和0.1g二氧化锰进行实验,反应前后容器中物质总质量随时间变化的关系如图。计算:
(1)制得氧气的质量是______
(2)参加反应的过氧化氢的质量。
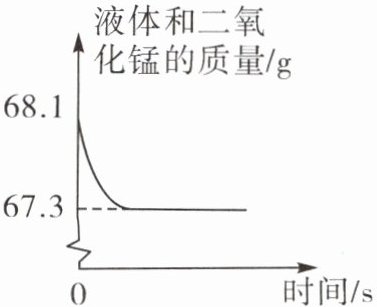
(1)制得氧气的质量是______
0.8 g
。(2)参加反应的过氧化氢的质量。

解:设参加反应的过氧化氢的质量为x。2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑ 68 32 x 0.8 g $\frac{68}{32}$=$\frac{x}{0.8\,\text{g}}$ x=1.7 g 答:参加反应的过氧化氢的质量为1.7 g。
答案:
3.
(1)0.8 g
(2)解:设参加反应的过氧化氢的质量为x。2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑ 68 32 x 0.8 g $\frac{68}{32}$=$\frac{x}{0.8\,\text{g}}$ x=1.7 g 答:参加反应的过氧化氢的质量为1.7 g。
(1)0.8 g
(2)解:设参加反应的过氧化氢的质量为x。2H₂O₂$\frac{\underline{\text{MnO}_2}}{}$2H₂O+O₂↑ 68 32 x 0.8 g $\frac{68}{32}$=$\frac{x}{0.8\,\text{g}}$ x=1.7 g 答:参加反应的过氧化氢的质量为1.7 g。
查看更多完整答案,请扫码查看


