第96页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
10.取一定质量的CaCO₃高温灼烧一定时间(CaCO₃$\stackrel{高温}{=\!=\!=}$CaO + CO₂↑),测得反应后剩余固体的质量为35.2g,其中钙元素的质量分数为50%,则反应放出的CO₂的质量为 ( )
A.2.2g B.4.4g C.8.8g D.10g
A.2.2g B.4.4g C.8.8g D.10g
答案:
C [解析]碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,反应前后钙元素的质量不发生改变,钙元素的质量为35.2g×50% = 17.6g,故碳酸钙的质量为17.6g÷($\frac{40}{100}$×100%) = 44g,根据质量守恒定律,化学反应前后物质的总质量不变,生成的二氧化碳的质量为44g - 35.2g = 8.8g。故选:C。
11.“天宫”空间站中实现水循环的方法之一。
(1)用电解水的方法得到氢气,发生反应的化学方程式是____________________________。
(2)再利用4H₂ + CO₂$\stackrel{一定条件}{=\!=\!=}$2H₂O + CH₄反应原理得到水。计算生成18kg水,需要二氧化碳的质量是________。
(1)用电解水的方法得到氢气,发生反应的化学方程式是____________________________。
(2)再利用4H₂ + CO₂$\stackrel{一定条件}{=\!=\!=}$2H₂O + CH₄反应原理得到水。计算生成18kg水,需要二氧化碳的质量是________。
答案:
(1)2H₂O$\stackrel{通电}{=\!=\!=}$2H₂↑ + O₂↑
(2)4 22kg
[解析]
(1)水通电分解生成氢气和氧气,反应的化学方程式为2H₂O$\stackrel{通电}{=\!=\!=}$2H₂↑ + O₂↑。
(2)根据质量守恒定律,化学反应前后原子的种类和数目都不变,反应后有8个氢原子、2个氧原子和1个碳原子,反应前有1个碳原子、2个氧原子和2个氢原子,则氢气的前面的系数应为4。设生成18kg水,需要二氧化碳的质量是x。
4H₂ + CO₂$\stackrel{一定条件}{=\!=\!=}$2H₂O + CH₄
44 36
x 18kg
$\frac{44}{x}$ = $\frac{36}{18kg}$,解得x = 22kg。
(1)2H₂O$\stackrel{通电}{=\!=\!=}$2H₂↑ + O₂↑
(2)4 22kg
[解析]
(1)水通电分解生成氢气和氧气,反应的化学方程式为2H₂O$\stackrel{通电}{=\!=\!=}$2H₂↑ + O₂↑。
(2)根据质量守恒定律,化学反应前后原子的种类和数目都不变,反应后有8个氢原子、2个氧原子和1个碳原子,反应前有1个碳原子、2个氧原子和2个氢原子,则氢气的前面的系数应为4。设生成18kg水,需要二氧化碳的质量是x。
4H₂ + CO₂$\stackrel{一定条件}{=\!=\!=}$2H₂O + CH₄
44 36
x 18kg
$\frac{44}{x}$ = $\frac{36}{18kg}$,解得x = 22kg。
12.镁在空气中燃烧,生成氧化镁,测得反应过程中固体质量变化如图所示,请回答下列问题:
(1)氧化镁的相对分子质量为________。
(2)根据图示可知,参加反应的氧气的质量为________g。
(3)实验结束后,5g固体混合物中镁单质的质量分数为________。
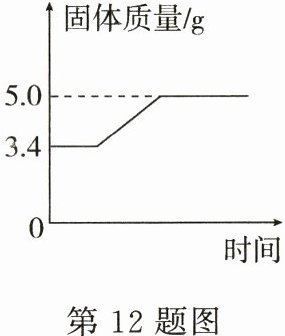
(1)氧化镁的相对分子质量为________。
(2)根据图示可知,参加反应的氧气的质量为________g。
(3)实验结束后,5g固体混合物中镁单质的质量分数为________。

答案:
(1)40
(2)1.6
(3)20%
[解析]
(1)氧化镁的相对分子质量为24 + 16 = 40。
(2)根据质量守恒定律,固体增加的质量为参加反应的氧气的质量,则参加反应的氧气的质量为5.0g - 3.4g = 1.6g。
(3)设反应生成的氧化镁的质量为x。
2Mg + O₂$\stackrel{点燃}{=\!=\!=}$2MgO
32 80
1.6g x
$\frac{32}{1.6g}$ = $\frac{80}{x}$,解得x = 4g。则5g固体混合物中镁单质的质量分数为$\frac{5g - 4g}{5g}$×100% = 20%。
(1)40
(2)1.6
(3)20%
[解析]
(1)氧化镁的相对分子质量为24 + 16 = 40。
(2)根据质量守恒定律,固体增加的质量为参加反应的氧气的质量,则参加反应的氧气的质量为5.0g - 3.4g = 1.6g。
(3)设反应生成的氧化镁的质量为x。
2Mg + O₂$\stackrel{点燃}{=\!=\!=}$2MgO
32 80
1.6g x
$\frac{32}{1.6g}$ = $\frac{80}{x}$,解得x = 4g。则5g固体混合物中镁单质的质量分数为$\frac{5g - 4g}{5g}$×100% = 20%。
13.15.5克红磷在氧气中充分燃烧,可生成五氧化二磷多少克?
答案:
解:设可生成五氧化二磷的质量为x。
4P + 5O₂$\stackrel{点燃}{=\!=\!=}$2P₂O₅
124 284
15.5g x
$\frac{124}{15.5g}$ = $\frac{284}{x}$,
解得x = 35.5g。
答:可生成五氧化二磷35.5克。
4P + 5O₂$\stackrel{点燃}{=\!=\!=}$2P₂O₅
124 284
15.5g x
$\frac{124}{15.5g}$ = $\frac{284}{x}$,
解得x = 35.5g。
答:可生成五氧化二磷35.5克。
14.在实验室以高锰酸钾为原料制取4.8kg氧气,需要多少千克高锰酸钾?
答案:
解:设需要高锰酸钾的质量为x。
2KMnO₄$\stackrel{\triangle}{=\!=\!=}$K₂MnO₄ + MnO₂ + O₂↑
316 32
x 4.8kg
$\frac{316}{x}$ = $\frac{32}{4.8kg}$,
解得x = 47.4kg。
答:需要47.4千克高锰酸钾。
2KMnO₄$\stackrel{\triangle}{=\!=\!=}$K₂MnO₄ + MnO₂ + O₂↑
316 32
x 4.8kg
$\frac{316}{x}$ = $\frac{32}{4.8kg}$,
解得x = 47.4kg。
答:需要47.4千克高锰酸钾。
15.34g过氧化氢完全分解产生氧气的质量为多少克?产生氧气的体积为多少升(标准状况下氧气的密度为1.43g/L)?
答案:
解:设34g过氧化氢完全分解产生氧气的质量为x。
2H₂O₂$\stackrel{MnO₂}{=\!=\!=}$2H₂O + O₂↑
68 32
34g x
$\frac{68}{32}$ = $\frac{34g}{x}$,
解得x = 16g。
V = $\frac{m}{\rho}$ = $\frac{16g}{1.43g/L}$≈11.19L。
答:34g过氧化氢完全分解产生氧气的质量为16克,产生氧气的体积为11.19升。
2H₂O₂$\stackrel{MnO₂}{=\!=\!=}$2H₂O + O₂↑
68 32
34g x
$\frac{68}{32}$ = $\frac{34g}{x}$,
解得x = 16g。
V = $\frac{m}{\rho}$ = $\frac{16g}{1.43g/L}$≈11.19L。
答:34g过氧化氢完全分解产生氧气的质量为16克,产生氧气的体积为11.19升。
查看更多完整答案,请扫码查看


