第90页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
8.某纯净物在氧气中燃烧生成二氧化碳和水,则该物质中一定含有____________元素,可能含有________元素。
答案:
碳、氢 氧
[解析]根据质量守恒定律,化学反应前后元素的种类不变,参加反应的氧气中含有氧元素,则该物质中一定含有碳、氢元素,可能含有氧元素。
[解析]根据质量守恒定律,化学反应前后元素的种类不变,参加反应的氧气中含有氧元素,则该物质中一定含有碳、氢元素,可能含有氧元素。
9.某物质受热分解成二氧化碳和水,则该物质中一定含有________元素。
答案:
碳、氢、氧
[解析]某物质受热分解成二氧化碳和水,生成物二氧化碳和水中含有碳、氢、氧三种元素,则反应物中也一定含有这三种元素,因此该物质中一定含有碳、氢、氧三种元素。
[解析]某物质受热分解成二氧化碳和水,生成物二氧化碳和水中含有碳、氢、氧三种元素,则反应物中也一定含有这三种元素,因此该物质中一定含有碳、氢、氧三种元素。
10.在化学反应A+B=C+D中,5gA与8gB恰好完全反应,生成4gC,则生成D的质量为________,若有30gA参加反应,则需要B的质量为________,生成D的质量为________。
答案:
9g 48g 54g
[解析]在化学反应A + B = C + D中,5gA与8gB恰好完全反应,生成4gC,根据质量守恒定律,则反应后生成的D的质量为:5g + 8g - 4g = 9g;若有30gA参加反应,则设需要B的质量为x,5:8 = 30:x,解得x = 48g,设生成D的质量为y,5:9 = 30:y,解得y = 54g。
[解析]在化学反应A + B = C + D中,5gA与8gB恰好完全反应,生成4gC,根据质量守恒定律,则反应后生成的D的质量为:5g + 8g - 4g = 9g;若有30gA参加反应,则设需要B的质量为x,5:8 = 30:x,解得x = 48g,设生成D的质量为y,5:9 = 30:y,解得y = 54g。
11.把A、B、C、D四种纯净物放在密闭容器中,在一定条件下充分反应,反应前后各物质的质量如下表。
回答下列问题:
(1)反应后D的质量是________g;
(2)该反应的基本反应类型是________;
(3)C物质可能是________(填“反应物”“生成物”或“催化剂”);
(4)参加反应的B与生成的A的质量比是________。

回答下列问题:
(1)反应后D的质量是________g;
(2)该反应的基本反应类型是________;
(3)C物质可能是________(填“反应物”“生成物”或“催化剂”);
(4)参加反应的B与生成的A的质量比是________。

答案:
(1)10.6
(2)分解反应
(3)催化剂
(4)245:149
[解析]
(1)根据表中数据分析可知,反应后A的质量增加了16.9g − 2g = 14.9g,故A是生成物,反应后B的质量是0g,故B是反应物,C在反应前后质量没有发生变化,故C可能是催化剂,故D也是生成物,根据质量守恒定律可知,参加反应的B的质量等于生成的A和D的质量之和,故生成的D的质量是24.5g − 14.9g = 9.6g,故反应后D的质量是1g + 9.6g = 10.6g;
(2)由上述分析可知,该反应是B在一定条件下分解生成A和D,故该反应的基本反应类型是分解反应;
(3)由于C物质在反应前后质量没有发生变化,故C物质可能是催化剂;
(4)参加反应的B的质量是24.5g,生成的A的质量是14.9g,故二者的质量比是24.5g:14.9g = 245:149。
(1)10.6
(2)分解反应
(3)催化剂
(4)245:149
[解析]
(1)根据表中数据分析可知,反应后A的质量增加了16.9g − 2g = 14.9g,故A是生成物,反应后B的质量是0g,故B是反应物,C在反应前后质量没有发生变化,故C可能是催化剂,故D也是生成物,根据质量守恒定律可知,参加反应的B的质量等于生成的A和D的质量之和,故生成的D的质量是24.5g − 14.9g = 9.6g,故反应后D的质量是1g + 9.6g = 10.6g;
(2)由上述分析可知,该反应是B在一定条件下分解生成A和D,故该反应的基本反应类型是分解反应;
(3)由于C物质在反应前后质量没有发生变化,故C物质可能是催化剂;
(4)参加反应的B的质量是24.5g,生成的A的质量是14.9g,故二者的质量比是24.5g:14.9g = 245:149。
12.一段蜡烛燃烧前的质量是mg,燃烧后的质量是ng,生成二氧化碳ag,水蒸气bg,则反应后生成的各物质的质量之和是________g,参加反应的石蜡的质量是________g,所消耗的氧气的质量是__________________g。
答案:
(a + b) (m − n) (a + b − m + n)
[解析]蜡烛燃烧反应的文字表达式是:石蜡 + 氧气$\stackrel{点燃}{→}$二氧化碳 + 水,生成的二氧化碳和水蒸气的质量和是(a + b)g;参加反应的石蜡的质量是(m − n)g;根据质量守恒定律可知,所消耗的氧气的质量是[(a + b)−(m − n)]g,故所消耗的氧气的质量是(a + b − m + n)g。
[解析]蜡烛燃烧反应的文字表达式是:石蜡 + 氧气$\stackrel{点燃}{→}$二氧化碳 + 水,生成的二氧化碳和水蒸气的质量和是(a + b)g;参加反应的石蜡的质量是(m − n)g;根据质量守恒定律可知,所消耗的氧气的质量是[(a + b)−(m − n)]g,故所消耗的氧气的质量是(a + b − m + n)g。
13.化学兴趣小组用气密性良好的不同装置进行下列实验,验证质量守恒定律。
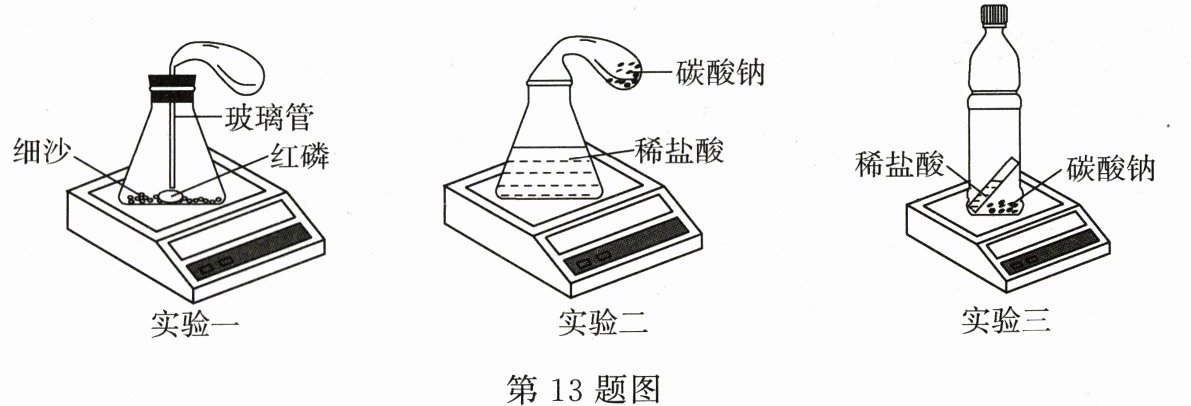
(1)实验一:称量装置和试剂的总质量为m₁,保持装置密闭,使红磷燃烧,待装置冷却后,再次称量装置和试剂的总质量为m₂,m₁与m₂的大小关系是:m₁________m₂;
(2)实验二:将气球中的碳酸钠粉末倒入锥形瓶中,观察到的现象是________________________;
(3)为克服实验二中气球受浮力的影响,在实验三中利用硬塑料纸改进实验装置,用电子天平称量装置和试剂的总质量,接下来的实验操作是______________________________,待反应结束后,再次称量装置和试剂的总质量,电子天平示数不变;
(4)化学反应遵守质量守恒定律,其微观原因是______________________________。

(1)实验一:称量装置和试剂的总质量为m₁,保持装置密闭,使红磷燃烧,待装置冷却后,再次称量装置和试剂的总质量为m₂,m₁与m₂的大小关系是:m₁________m₂;
(2)实验二:将气球中的碳酸钠粉末倒入锥形瓶中,观察到的现象是________________________;
(3)为克服实验二中气球受浮力的影响,在实验三中利用硬塑料纸改进实验装置,用电子天平称量装置和试剂的总质量,接下来的实验操作是______________________________,待反应结束后,再次称量装置和试剂的总质量,电子天平示数不变;
(4)化学反应遵守质量守恒定律,其微观原因是______________________________。
答案:
(1)=
(2)产生气泡,气球膨胀,电子天平示数减小
(3)倾斜瓶子,使稀盐酸和碳酸钠混合
(4)化学反应前后原子的种类、个数和质量都不变
[解析]
(1)实验一:称量装置和试剂的总质量为m₁,保持装置密闭,使红磷燃烧,待装置冷却后,再次称量装置和试剂的总质量为m₂,m₁与m₂的大小关系是:m₁ = m₂。故答案为:=。
(2)实验二:将气球中的碳酸钠粉末倒入锥形瓶中,观察到的现象是产生气泡,气球膨胀,电子天平示数减小(气球膨胀产生向上的浮力)。故答案为:产生气泡,气球膨胀,电子天平示数减小。
(3)为克服实验二中气球受浮力的影响,在实验三中利用硬塑料纸改进实验装置,用电子天平称量装置和试剂的总质量,接下来的实验操作是倾斜瓶子,使稀盐酸和碳酸钠混合,待反应结束后,再次称量装置和试剂的总质量,电子天平示数不变。故答案为:倾斜瓶子,使稀盐酸和碳酸钠混合。
(4)化学反应遵守质量守恒定律,其微观原因是化学反应前后原子的种类、个数和质量都不变。故答案为:化学反应前后原子的种类、个数和质量都不变。
(1)=
(2)产生气泡,气球膨胀,电子天平示数减小
(3)倾斜瓶子,使稀盐酸和碳酸钠混合
(4)化学反应前后原子的种类、个数和质量都不变
[解析]
(1)实验一:称量装置和试剂的总质量为m₁,保持装置密闭,使红磷燃烧,待装置冷却后,再次称量装置和试剂的总质量为m₂,m₁与m₂的大小关系是:m₁ = m₂。故答案为:=。
(2)实验二:将气球中的碳酸钠粉末倒入锥形瓶中,观察到的现象是产生气泡,气球膨胀,电子天平示数减小(气球膨胀产生向上的浮力)。故答案为:产生气泡,气球膨胀,电子天平示数减小。
(3)为克服实验二中气球受浮力的影响,在实验三中利用硬塑料纸改进实验装置,用电子天平称量装置和试剂的总质量,接下来的实验操作是倾斜瓶子,使稀盐酸和碳酸钠混合,待反应结束后,再次称量装置和试剂的总质量,电子天平示数不变。故答案为:倾斜瓶子,使稀盐酸和碳酸钠混合。
(4)化学反应遵守质量守恒定律,其微观原因是化学反应前后原子的种类、个数和质量都不变。故答案为:化学反应前后原子的种类、个数和质量都不变。
14.(2024.绥化中考)现将40gA和足量的B混合加热。A与B发生化学反应,40gA完全反应后生成32gC和22gD,则参加反应的B与生成的D的质量比是( )
A.20:7 B.7:11 C.5:4 D.16:11
A.20:7 B.7:11 C.5:4 D.16:11
答案:
B [解析]40gA完全反应后生成32gC和22gD,由质量守恒定律可知,参加反应的B的质量 = 32g + 22g − 40g = 14g,则参加反应的B与生成的D的质量比是14g:22g = 7:11。故选:B。
查看更多完整答案,请扫码查看


