第28页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
8. 在探究“分解过氧化氢制取氧气的反应中二氧化锰的作用”实验中,向盛有过氧化氢溶液的试管中加入少量二氧化锰粉末,待试管中不再发生现象时重新加入过氧化氢溶液,这样重复几次,发现只有过氧化氢在消耗,二氧化锰好像永远也没有用完。这说明了二氧化锰在这个反应中,其质量和化学性质没有改变,因此它不是反应物。
答案:
质量 化学性质
9. 学习制取气体和探究其性质是初中阶段学生要掌握的基本技能之一。
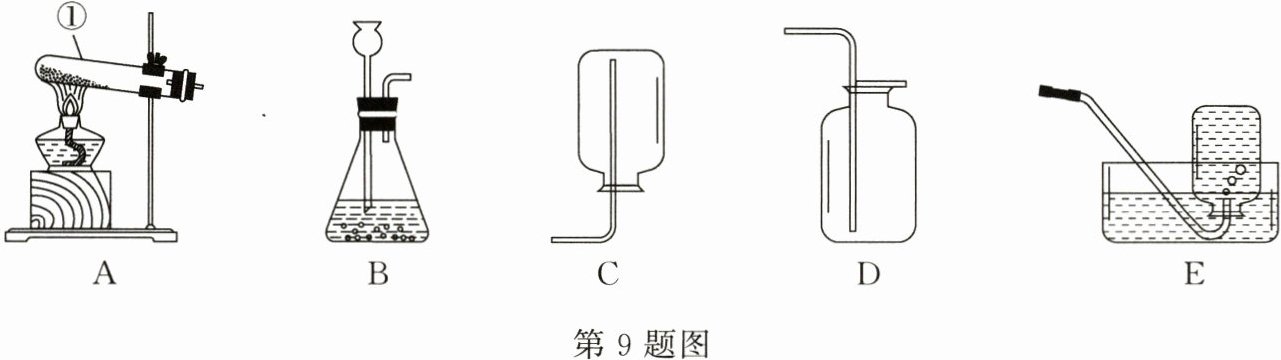
(1) 仪器①的名称是________。
(2) 若实验室用过氧化氢溶液制取氧气,发生装置可采用________(填字母)装置,该反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气。
(3) 氧气既可以用D装置也可以用E装置收集的原因是氧气不易溶于水且密度比空气大。
(1) 仪器①的名称是________。
(2) 若实验室用过氧化氢溶液制取氧气,发生装置可采用________(填字母)装置,该反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气。
(3) 氧气既可以用D装置也可以用E装置收集的原因是氧气不易溶于水且密度比空气大。

答案:
(1)试管
(2)B 过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气
(3)氧气的密度比空气大,不易溶于水
[解析]
(1)仪器①的名称是试管。
(2)若实验室用过氧化氢溶液制取氧气,该反应为固液常温型,发生装置可采用B装置;过氧化氢在二氧化锰的催化作用下分解生成氧气和水,该反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气。
(3)氧气既可以用D装置也可以用E装置收集的原因是氧气的密度比空气大,不易溶于水。
(1)试管
(2)B 过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气
(3)氧气的密度比空气大,不易溶于水
[解析]
(1)仪器①的名称是试管。
(2)若实验室用过氧化氢溶液制取氧气,该反应为固液常温型,发生装置可采用B装置;过氧化氢在二氧化锰的催化作用下分解生成氧气和水,该反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气。
(3)氧气既可以用D装置也可以用E装置收集的原因是氧气的密度比空气大,不易溶于水。
10. 回归教材(2024.山西中考)探究“分解过氧化氢制氧气的反应中二氧化锰的作用”。
第10题图
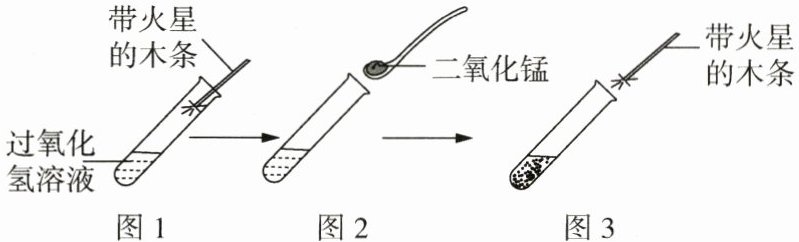
(1) 实验方法: ①向图1试管中加入5mL5%的过氧化氢溶液,把带火星的木条伸入试管,观察现象。②向图2试管中加入少量二氧化锰,把带火星的木条伸入试管,观察现象。③待试管中没有现象发生时,重复进行①的实验操作,观察现象。
(2) 实验原理: 图2中发生反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气。
(3) 实验现象: 图1中带火星的木条不复燃。图3中的现象是带火星的木条复燃。
(4) 实验结论: 二氧化锰可使过氧化氢分解的速率加快。
[问题与思考]
(1) 研究表明,二氧化锰是该反应的催化剂,它在反应前后的化学性质无(填“有”或“无”)变化。
(2) 常温下,图1试管中也产生了氧气,但带火星的木条不能复燃的原因可能是产生氧气的量较少。
第10题图
(1) 实验方法: ①向图1试管中加入5mL5%的过氧化氢溶液,把带火星的木条伸入试管,观察现象。②向图2试管中加入少量二氧化锰,把带火星的木条伸入试管,观察现象。③待试管中没有现象发生时,重复进行①的实验操作,观察现象。
(2) 实验原理: 图2中发生反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气。
(3) 实验现象: 图1中带火星的木条不复燃。图3中的现象是带火星的木条复燃。
(4) 实验结论: 二氧化锰可使过氧化氢分解的速率加快。
[问题与思考]
(1) 研究表明,二氧化锰是该反应的催化剂,它在反应前后的化学性质无(填“有”或“无”)变化。
(2) 常温下,图1试管中也产生了氧气,但带火星的木条不能复燃的原因可能是产生氧气的量较少。

答案:
(2)过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气
(3)带火星的木条复燃
(4)加快
[问题与思考]
(1)无
(2)常温下,过氧化氢分解速率太慢,产生的氧气太少
[解析]
(2)图2中过氧化氢在二氧化锰的催化作用下分解生成水和氧气,反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气。
(3)图3中观察到的现象是带火星的木条复燃,是因为过氧化氢在二氧化锰的催化作用下迅速分解产生大量的氧气。
(4)由图1和图3的现象可知,二氧化锰可使过氧化氢分解的速率加快。
[问题与思考]
(1)研究表明,二氧化锰是该反应的催化剂,它在反应前后的化学性质无变化。
(2)常温下,图1试管中也产生了氧气,但带火星的木条不能复燃的原因可能是常温下,过氧化氢分解速率太慢,产生的氧气太少。
(2)过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气
(3)带火星的木条复燃
(4)加快
[问题与思考]
(1)无
(2)常温下,过氧化氢分解速率太慢,产生的氧气太少
[解析]
(2)图2中过氧化氢在二氧化锰的催化作用下分解生成水和氧气,反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水 + 氧气。
(3)图3中观察到的现象是带火星的木条复燃,是因为过氧化氢在二氧化锰的催化作用下迅速分解产生大量的氧气。
(4)由图1和图3的现象可知,二氧化锰可使过氧化氢分解的速率加快。
[问题与思考]
(1)研究表明,二氧化锰是该反应的催化剂,它在反应前后的化学性质无变化。
(2)常温下,图1试管中也产生了氧气,但带火星的木条不能复燃的原因可能是常温下,过氧化氢分解速率太慢,产生的氧气太少。
查看更多完整答案,请扫码查看


