第83页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
9. 某钢铁厂采用赤铁矿冶炼钢铁,其主要工艺流程如图,请回答下列问题。
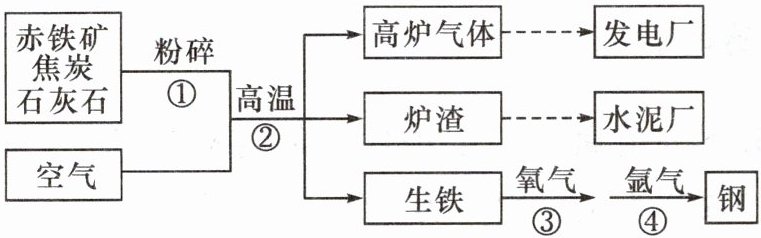
(1)在步骤①中将固体反应物粉碎的目的是
(2)高炉气体中除SO₂、CO外,主要成分还有
(3)在步骤④中吹入氩气,使钢水循环流动,使各部分均匀混合,相当于化学实验中

(1)在步骤①中将固体反应物粉碎的目的是
增大反应物之间的接触面积,加快反应速率
。(2)高炉气体中除SO₂、CO外,主要成分还有
氮气、二氧化碳(合理即可)
。(3)在步骤④中吹入氩气,使钢水循环流动,使各部分均匀混合,相当于化学实验中
玻璃棒
(填一种仪器名称)的作用。
答案:
(1)增大反应物之间的接触面积,加快反应速率
(2)氮气、二氧化碳(合理即可)
(3)玻璃棒
(1)增大反应物之间的接触面积,加快反应速率
(2)氮气、二氧化碳(合理即可)
(3)玻璃棒
10. 明代《天工开物》中记载了采矿和冶炼金属锡的过程。
(1)采矿。“水锡···其质黑色···愈经淘取”,水中淘取锡砂(指锡矿石)时,所用容器的孔径需
(2)冶炼。“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”其原理是高温下木炭会和锡砂(主要成分为SnO₂)反应,生成锡单质和一种空气中含有的气体,该过程中发生反应的化学方程式是
(1)采矿。“水锡···其质黑色···愈经淘取”,水中淘取锡砂(指锡矿石)时,所用容器的孔径需
小于
(填“大于”或“小于”)锡砂颗粒大小。(2)冶炼。“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”其原理是高温下木炭会和锡砂(主要成分为SnO₂)反应,生成锡单质和一种空气中含有的气体,该过程中发生反应的化学方程式是
$C + SnO₂ \stackrel{高温}{=} Sn + CO₂ ↑$
;用200t锡砂冶炼得到锡单质119t,则锡砂中SnO₂的含量为75.5%
。(Sn-119)
答案:
(1)小于
(2)$\mathrm{C + SnO_2 \stackrel{高温}{=} Sn + CO_2 \uparrow}$
$75.5\%$
(1)小于
(2)$\mathrm{C + SnO_2 \stackrel{高温}{=} Sn + CO_2 \uparrow}$
$75.5\%$
11. (2023·济宁)某兴趣小组为证明CO可以还原金属氧化物,采用如图所示装置进行实验。
【查询资料】
Ⅰ. 用甲酸与浓硫酸微热可生成CO,化学方程式为$HCOOH\xlongequal[\triangle]{浓硫酸}CO↑+H₂O。$
Ⅱ. HCOOH:熔点8.6℃,沸点100.8℃。
【实验装置】
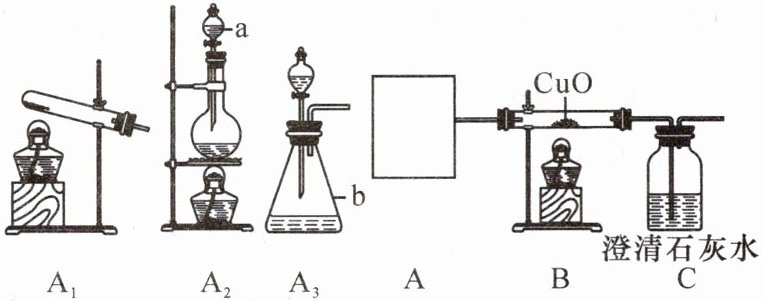
请回答:
(1)仪器a的名称是
(2)该兴趣小组在方框A中需选择
(3)写出B装置硬质玻璃管中发生反应的化学方程式:
(4)B装置硬质玻璃管中的现象是
(5)该小组经过交流讨论,得出该装置存在一定缺陷,具体是
【查询资料】
Ⅰ. 用甲酸与浓硫酸微热可生成CO,化学方程式为$HCOOH\xlongequal[\triangle]{浓硫酸}CO↑+H₂O。$
Ⅱ. HCOOH:熔点8.6℃,沸点100.8℃。
【实验装置】

请回答:
(1)仪器a的名称是
分液漏斗
,仪器b的名称是锥形瓶
。(2)该兴趣小组在方框A中需选择
A₂
(填“A₁”“A₂”或“A₃”)装置生成CO气体,然后与B装置对接完成实验。(3)写出B装置硬质玻璃管中发生反应的化学方程式:
CO + CuO \stackrel{\triangle}{=} Cu + CO₂
。(4)B装置硬质玻璃管中的现象是
黑色固体变为红色
。C装置中出现澄清石灰水变浑浊
的现象同样可以证明CO与氧化铜发生了反应。(5)该小组经过交流讨论,得出该装置存在一定缺陷,具体是
C装置后面缺少尾气处理装置
。
答案:
(1)分液漏斗 锥形瓶
(2)$\mathrm{A_2}$
(3)$\mathrm{CO + CuO \stackrel{\triangle}{=} Cu + CO_2}$
(4)黑色固体变为红色 澄清石灰水变浑浊
(5)C装置后面缺少尾气处理装置
(1)分液漏斗 锥形瓶
(2)$\mathrm{A_2}$
(3)$\mathrm{CO + CuO \stackrel{\triangle}{=} Cu + CO_2}$
(4)黑色固体变为红色 澄清石灰水变浑浊
(5)C装置后面缺少尾气处理装置
请写出4个有二氧化碳生成的化学方程式:
(1),(2),
(3),(4)。
(1),(2),
(3),(4)。
答案:
(1)${C + O_{2}\xlongequal{点燃}CO_{2}}$
(2)${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$
(3)${CO + CuO\xlongequal{\Delta}Cu + CO_{2}}$
(4)${CaCO_{3}\xlongequal{高温}CaO + CO_{2}\uparrow}$
(1)${C + O_{2}\xlongequal{点燃}CO_{2}}$
(2)${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$
(3)${CO + CuO\xlongequal{\Delta}Cu + CO_{2}}$
(4)${CaCO_{3}\xlongequal{高温}CaO + CO_{2}\uparrow}$
查看更多完整答案,请扫码查看


