第11页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
22. 某班同学分组研究碱的性质时,进行如图实验,观察到有蓝色絮状沉淀产生。一段时间后,发现试管中的沉淀有些小组部分变黑,有些小组仍为蓝色。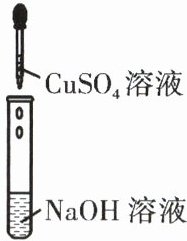
(1)反应生成的蓝色絮状沉淀物质是______。
(2)根据质量守恒定律,推测黑色物质可能是______(填字母)。
A. 铁 B. 碳 C. 二氧化锰 D. 氧化铜
(3)某同学认为试管中沉淀的颜色变黑可能是由于反应物的溶质质量分数较高所致。为验证猜想是否成立,他改用溶质质量分数更大的硫酸铜溶液再一次进行了实验,发现生成的蓝色絮状沉淀过一段时间并未变黑。因此,他认为自己的猜想是错误的。请回答,他能否据此否定自己的猜想?并说明理由。______。

(1)反应生成的蓝色絮状沉淀物质是______。
(2)根据质量守恒定律,推测黑色物质可能是______(填字母)。
A. 铁 B. 碳 C. 二氧化锰 D. 氧化铜
(3)某同学认为试管中沉淀的颜色变黑可能是由于反应物的溶质质量分数较高所致。为验证猜想是否成立,他改用溶质质量分数更大的硫酸铜溶液再一次进行了实验,发现生成的蓝色絮状沉淀过一段时间并未变黑。因此,他认为自己的猜想是错误的。请回答,他能否据此否定自己的猜想?并说明理由。______。
答案:
(1)氢氧化铜
(2)D
(3)不能;该实验仅改变硫酸铜溶液的溶质质量分数,未控制其他变量(如氢氧化钠溶液浓度、温度等),无法确定沉淀变黑是否与硫酸铜溶液溶质质量分数有关。
(1)氢氧化铜
(2)D
(3)不能;该实验仅改变硫酸铜溶液的溶质质量分数,未控制其他变量(如氢氧化钠溶液浓度、温度等),无法确定沉淀变黑是否与硫酸铜溶液溶质质量分数有关。
23. 已知某纯碱试样中含有杂质氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验。主要步骤如下,请回答下列问题。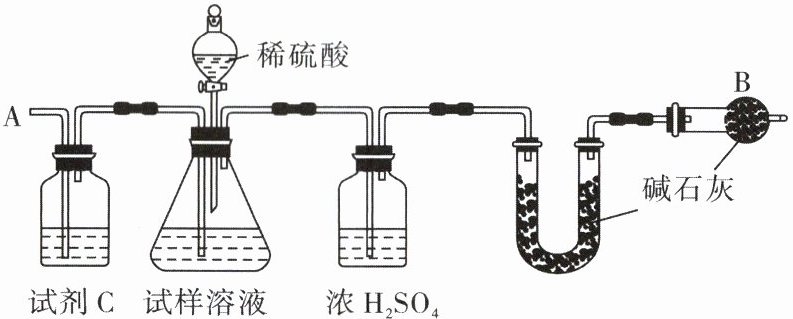
① 按图组装仪器,并检查______;
② 将10 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③ 称量盛有碱石灰的U形管的质量为300 g;
④ 从分液漏斗中滴入20%的稀硫酸,直到______为止;
⑤ 从导管A处缓缓鼓入一定量的空气;
⑥ 再次称量盛有碱石灰的U形管的质量;
⑦ 重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为303.3 g。
(1)试剂C的名称为______。
(2)装置中若没有干燥管B,测试的结果会______(填“偏大”“偏小”或“不变”)。
(3)试样中纯碱的质量分数为______。
(4)分液漏斗中的稀$H_2SO_4$能否换成浓盐酸,为什么?______。

① 按图组装仪器,并检查______;
② 将10 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③ 称量盛有碱石灰的U形管的质量为300 g;
④ 从分液漏斗中滴入20%的稀硫酸,直到______为止;
⑤ 从导管A处缓缓鼓入一定量的空气;
⑥ 再次称量盛有碱石灰的U形管的质量;
⑦ 重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为303.3 g。
(1)试剂C的名称为______。
(2)装置中若没有干燥管B,测试的结果会______(填“偏大”“偏小”或“不变”)。
(3)试样中纯碱的质量分数为______。
(4)分液漏斗中的稀$H_2SO_4$能否换成浓盐酸,为什么?______。
答案:
①装置气密性;④不再产生气泡;
(1)氢氧化钠溶液;
(2)偏大;
(3)79.5%;
(4)不能,浓盐酸具有挥发性,会使测得的二氧化碳质量偏大,导致纯碱质量分数偏大。
(1)氢氧化钠溶液;
(2)偏大;
(3)79.5%;
(4)不能,浓盐酸具有挥发性,会使测得的二氧化碳质量偏大,导致纯碱质量分数偏大。
24.(8分)在研究“酸与碱之间发生的反应”过程中,取一洁净的锥形瓶,往其中加入25 g氢氧化钠溶液,然后逐滴滴入质量分数为7.3%的稀盐酸。
(1)为了获取酸能与碱反应的证据,滴加稀盐酸前,锥形瓶中还需加入的是______。
(2)酸与碱之间反应的实质是______。
(3)滴加稀盐酸至恰好完全反应,锥形瓶及溶液总质量随加入稀盐酸质量的变化关系如图所示。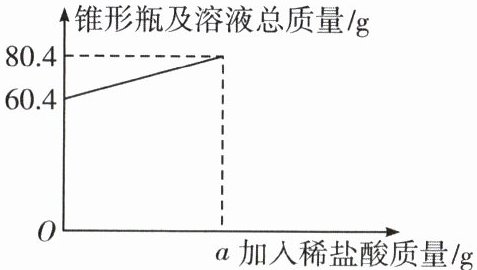
① a的值是______;
② 求反应后溶液中溶质的质量分数。
(1)为了获取酸能与碱反应的证据,滴加稀盐酸前,锥形瓶中还需加入的是______。
(2)酸与碱之间反应的实质是______。
(3)滴加稀盐酸至恰好完全反应,锥形瓶及溶液总质量随加入稀盐酸质量的变化关系如图所示。

① a的值是______;
② 求反应后溶液中溶质的质量分数。
答案:
(1)指示剂(如酚酞试液)
(2)$H^{+}+OH^{-}=H_{2}O$
(3)①$20$;②$5.2\%$
(2)$H^{+}+OH^{-}=H_{2}O$
(3)①$20$;②$5.2\%$
查看更多完整答案,请扫码查看


