第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
15. 某锥形瓶盛有盐酸和氯化铜的混合溶液100 g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量$m_1$与滴入的氢氧化钠溶液的质量$m_2$的变化关系如图所示。下列说法错误的是( )
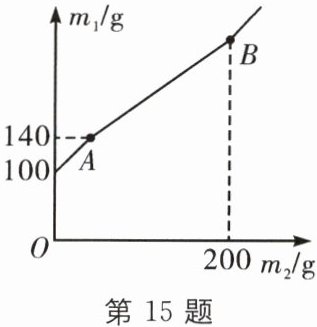
A.反应至A点时,所加NaOH溶液的质量为40 g
B.反应至A点时,溶液中的溶质有$CuCl_2$和NaCl
C.反应至B点时,锥形瓶内溶液的质量为280.4 g
D.反应至B点时,锥形瓶内溶液中NaCl的质量为23.4 g

A.反应至A点时,所加NaOH溶液的质量为40 g
B.反应至A点时,溶液中的溶质有$CuCl_2$和NaCl
C.反应至B点时,锥形瓶内溶液的质量为280.4 g
D.反应至B点时,锥形瓶内溶液中NaCl的质量为23.4 g
答案:
BD
16. 某同学用相同的铁钉探究铁生锈与哪些因素有关,设计的实验如图。经过一周观察:试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。

(1)比较B和C,说明铁生锈与______有关。
(2)A中蒸馏水要事先煮沸,并在其上方加入植物油,其目的是______。

(1)比较B和C,说明铁生锈与______有关。
(2)A中蒸馏水要事先煮沸,并在其上方加入植物油,其目的是______。
答案:
(1)水
(2)除去水中溶解的氧气并隔绝空气,防止空气中的氧气进入水中
(1)水
(2)除去水中溶解的氧气并隔绝空气,防止空气中的氧气进入水中
17. 盐酸在实验室有较多的使用,也呈现出不同的性质。

(1)实验室常用金属锌与稀盐酸来制取氢气,该反应的微观示意图如图甲、乙所示,其中“●”表示的离子是______。
(2)实验室选用溶质质量分数为22%的盐酸与足量的大理石制取二氧化碳时,产生二氧化碳的快慢与时间关系如图丙所示,在实验过程中发现,发生装置中的锥形瓶外壁发烫。推测图中第5~10分钟时反应快速变慢的主要原因是______。

(1)实验室常用金属锌与稀盐酸来制取氢气,该反应的微观示意图如图甲、乙所示,其中“●”表示的离子是______。
(2)实验室选用溶质质量分数为22%的盐酸与足量的大理石制取二氧化碳时,产生二氧化碳的快慢与时间关系如图丙所示,在实验过程中发现,发生装置中的锥形瓶外壁发烫。推测图中第5~10分钟时反应快速变慢的主要原因是______。
答案:
(1)氢离子(或H⁺)
(2)盐酸浓度降低
(1)氢离子(或H⁺)
(2)盐酸浓度降低
18. 一包白色固体,可能由硫酸钾、氢氧化钾、碳酸钙、氯化钡中的一种或几种组成。为探究该白色固体的组成,某小组取适量样品按如图所示的流程进行实验。请回答下列问题。
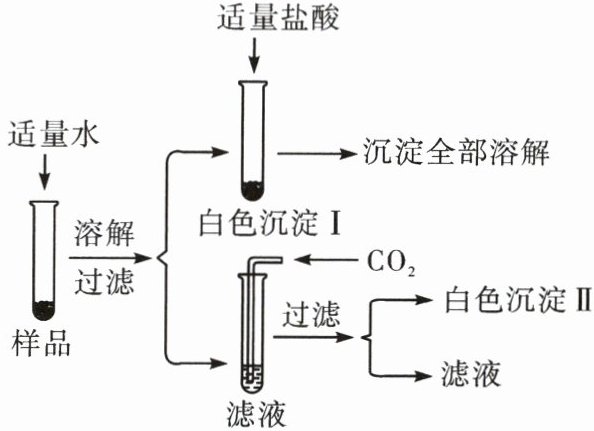
(1)写出白色沉淀Ⅰ与稀盐酸反应的化学方程式:______。
(2)白色沉淀Ⅱ的化学式为______。
(3)原白色固体中含有的物质的化学式为______。

(1)写出白色沉淀Ⅰ与稀盐酸反应的化学方程式:______。
(2)白色沉淀Ⅱ的化学式为______。
(3)原白色固体中含有的物质的化学式为______。
答案:
(1)CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
(2)BaCO₃
(3)CaCO₃、KOH、BaCl₂
(1)CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
(2)BaCO₃
(3)CaCO₃、KOH、BaCl₂
查看更多完整答案,请扫码查看


