第30页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
24. (8分)5G通信需要大量光纤连接各种基站,在光纤的表面涂Cu-Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu-Al合金层中铝的质量分数,小科进行了相关实验,测得实验数据如表所示,则:
| |甲|乙|丙|
|加入Cu-Al合金层样品粉末的质量/g|10|10|20|
|加入稀硫酸的质量/g|100|50|50|
|烧杯中剩余物的质量/g|109|59|69|
(1)实验中Cu-Al合金层样品粉末与稀硫酸恰好完全反应的实验是______(填“甲”“乙”或“丙”)。
(2)该Cu-Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)
| |甲|乙|丙|
|加入Cu-Al合金层样品粉末的质量/g|10|10|20|
|加入稀硫酸的质量/g|100|50|50|
|烧杯中剩余物的质量/g|109|59|69|

(1)实验中Cu-Al合金层样品粉末与稀硫酸恰好完全反应的实验是______(填“甲”“乙”或“丙”)。
(2)该Cu-Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)
答案:
(1)乙
(2)解:乙实验中生成氢气的质量为10g+50g-59g=1g。
设10g Cu-Al合金中铝的质量为x。
2Al+3H₂SO₄=Al₂(SO₄)₃+3H₂↑
54 6
x 1g
54/6=x/1g
x=9g
该Cu-Al合金层样品粉末中铝的质量分数为9g/10g×100%=90%
答:该Cu-Al合金层样品粉末中铝的质量分数为90%。
(1)乙
(2)解:乙实验中生成氢气的质量为10g+50g-59g=1g。
设10g Cu-Al合金中铝的质量为x。
2Al+3H₂SO₄=Al₂(SO₄)₃+3H₂↑
54 6
x 1g
54/6=x/1g
x=9g
该Cu-Al合金层样品粉末中铝的质量分数为9g/10g×100%=90%
答:该Cu-Al合金层样品粉末中铝的质量分数为90%。
25. (12分)工业纯碱中含少量氯化钠。兴趣小组分别采用不同的方法测定工业纯碱样品中碳酸钠的质量分数。
| |烧杯1|烧杯2|烧杯3|
|样品溶液/g|10|20|30|
|氯化钙溶液/g|30|30|30|
|沉淀质量/g|2|4|5|
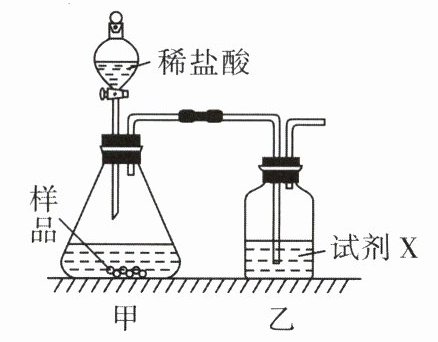

(1)方法一:差量法。称取W g样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用______。
(2)方法二:沉淀法。称取15 g样品完全溶解于水中配成60 g样品溶液,取三个烧杯分三次进行实验,每次加入30 g氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表所示。计算样品中碳酸钠的质量分数。$(Na_2CO_3+CaCl_2——CaCO_3↓+2NaCl)$
(3)请写出提高方法一测量精确度的操作建议。(写出2点)
| |烧杯1|烧杯2|烧杯3|
|样品溶液/g|10|20|30|
|氯化钙溶液/g|30|30|30|
|沉淀质量/g|2|4|5|


(1)方法一:差量法。称取W g样品与足量的稀盐酸充分反应,生成的二氧化碳通过装有试剂X的乙装置,并测量乙装置增加的质量,求得样品中碳酸钠的质量分数。该方法中试剂X可选用______。
(2)方法二:沉淀法。称取15 g样品完全溶解于水中配成60 g样品溶液,取三个烧杯分三次进行实验,每次加入30 g氯化钙溶液充分反应,过滤、洗涤、干燥所得的沉淀质量记录如表所示。计算样品中碳酸钠的质量分数。$(Na_2CO_3+CaCl_2——CaCO_3↓+2NaCl)$
(3)请写出提高方法一测量精确度的操作建议。(写出2点)
答案:
(1)氢氧化钠溶液
(2)解:设20g样品溶液中碳酸钠的质量为x
$\begin{array}{ccccccccc}\mathrm{Na_2CO_3}&+&\mathrm{CaCl_2}&=&\mathrm{CaCO_3}\downarrow&+&2\mathrm{NaCl}\\106&&&&100&&\\x&&&&4\ g&&\end{array}$
$\frac{106}{100}=\frac{x}{4\ g}$
$x=4.24\ g$
60g样品溶液中碳酸钠的质量为$4.24\ g×\frac{60\ g}{20\ g}=12.72\ g$
样品中碳酸钠的质量分数为$\frac{12.72\ g}{15\ g}×100\% =84.8\%$
(3)在乙装置后连接盛有碱石灰的干燥管;反应结束后通入氮气将装置内残留的二氧化碳赶入乙装置
(1)氢氧化钠溶液
(2)解:设20g样品溶液中碳酸钠的质量为x
$\begin{array}{ccccccccc}\mathrm{Na_2CO_3}&+&\mathrm{CaCl_2}&=&\mathrm{CaCO_3}\downarrow&+&2\mathrm{NaCl}\\106&&&&100&&\\x&&&&4\ g&&\end{array}$
$\frac{106}{100}=\frac{x}{4\ g}$
$x=4.24\ g$
60g样品溶液中碳酸钠的质量为$4.24\ g×\frac{60\ g}{20\ g}=12.72\ g$
样品中碳酸钠的质量分数为$\frac{12.72\ g}{15\ g}×100\% =84.8\%$
(3)在乙装置后连接盛有碱石灰的干燥管;反应结束后通入氮气将装置内残留的二氧化碳赶入乙装置
查看更多完整答案,请扫码查看


