第4页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
1. (浙江中考)下列模型(“”表示氧原子, “”表示碳原子)中,能表示一氧化碳分子 的是 (
C
)
答案:
C
2. (安徽中考)青藏高原上积雪和冰川广布,冰雪融水是江河源头的重要补给水源。下列说法中,正确的是 (
A.水结冰时,水分子不再运动
B.冰融化时,水分子的种类发生了变化
C.冰升华时,水分子间的间隔增大
D.冰与水混合得到混合物
C
)A.水结冰时,水分子不再运动
B.冰融化时,水分子的种类发生了变化
C.冰升华时,水分子间的间隔增大
D.冰与水混合得到混合物
答案:
C
3. 新情境 社会热点 对于日本政府将福岛第一核电站的核污水排入大海的决定,多国对此表示反对。当地时间2025年3月12日,日本东京电力公司已开始了第11轮福岛第一核电站核污水排海。核污水中含有氚,如图所示为氚原子结构示意图,由图可知氚原子 (
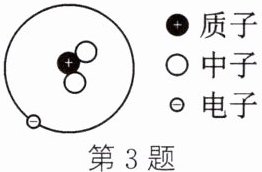
A.含有2个质子
B.核电荷数为1
C.相对原子质量为4
D.质子数和中子数相等
B
)
A.含有2个质子
B.核电荷数为1
C.相对原子质量为4
D.质子数和中子数相等
答案:
B 解析:根据图示可知,氚原子含有1个质子,A错误;核电荷数=质子数,据图可知氚原子含有1个质子,因此其核电荷数为1,B正确;相对原子质量≈质子数+中子数,据图可知氚原子含有1个质子、2个中子,因此其相对原子质量≈3,C错误;据图可知,氚原子含有1个质子、2个中子,因此其质子数和中子数不相等,D错误。
易错提示
原子的结构和原子种类的辨析
原子一般是由质子、中子和电子构成的,有的原子不一定有中子,质子数也不一定等于中子数。原子的种类由核电荷数(质子数)决定。
易错提示
原子的结构和原子种类的辨析
原子一般是由质子、中子和电子构成的,有的原子不一定有中子,质子数也不一定等于中子数。原子的种类由核电荷数(质子数)决定。
4. (深圳中考)嫦娥五号从月球上带回来的样品有氦气和钛铁矿石。下列有关氦、钛元素(如图)的说法,正确的是 (

A.1个氦原子含有4个质子
B.钛原子的相对原子质量为47.87g
C.钛原子的最外层电子数为22
D.He和Ti分别可以表示单质
D
)
A.1个氦原子含有4个质子
B.钛原子的相对原子质量为47.87g
C.钛原子的最外层电子数为22
D.He和Ti分别可以表示单质
答案:
D
5. 由地壳中含量最多的金属元素、非金属元素和空气中含量最多的元素组成的化合物的化学式为 (
A. Al(NO₃)₃
B. CaCO₃
C. Al₂(SO₄)₃
D. Fe(NO₃)₃
A
)A. Al(NO₃)₃
B. CaCO₃
C. Al₂(SO₄)₃
D. Fe(NO₃)₃
答案:
A
6. 在科学世界里,没有生命的阿拉伯数字也变得鲜活起来,它们在不同的位置时表示不同的含义。下列有关化学符号中数字“2”表示的意义的说法,正确的是 (
$A.CO_2$:1个二氧化碳分子中含有2个氧原子
$B.Mg^2⁺$:1个镁原子带2个单位正电荷
C.$\overset{+2}{\text{Ca}}\text{O}$:氧化钙的化合价为+2
D.2H:2个氢元素
A
)$A.CO_2$:1个二氧化碳分子中含有2个氧原子
$B.Mg^2⁺$:1个镁原子带2个单位正电荷
C.$\overset{+2}{\text{Ca}}\text{O}$:氧化钙的化合价为+2
D.2H:2个氢元素
答案:
A
7. 新素养 科学思维 正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比,质量相等,但电性相反。科学家已发现反氢原子,你推测反氢原子的结构可能是 (
A.由一个负质子和一个正电子构成
B.由一个质子和一个电子构成
C.由一个负质子和一个电子构成
D.由一个质子和一个正电子构成
A
)A.由一个负质子和一个正电子构成
B.由一个质子和一个电子构成
C.由一个负质子和一个电子构成
D.由一个质子和一个正电子构成
答案:
A
8. 新素养 模型构建 “○”和“●”分别表示不同元素的原子,其中表示单质的是 (

D
)
答案:
D
9. 乙硫醇(化学式为$C_2H_6S)$易挥发,有蒜臭味,人对该气味极其敏感。下列有关乙硫醇的说法,不正确的是 (
A.乙硫醇的相对分子质量为62
B.乙硫醇中C、H、S三种元素的质量比为2:6:1
C.硫元素的质量分数约为51.6%
D.在管道煤气中添加微量乙硫醇,目的是在煤气泄漏时能及时发现
B
)A.乙硫醇的相对分子质量为62
B.乙硫醇中C、H、S三种元素的质量比为2:6:1
C.硫元素的质量分数约为51.6%
D.在管道煤气中添加微量乙硫醇,目的是在煤气泄漏时能及时发现
答案:
B 解析:乙硫醇的相对分子质量为12×2+1×6+32=62,故A不符合题意;乙硫醇中C、H、S三种元素的质量比为(12×2):(1×6):32=12:3:16,故B符合题意;硫元素的质量分数为$\frac{32}{12×2+1×6+32}×100\%≈51.6\%$,故C不符合题意;乙硫醇易挥发,有蒜臭味,人对该气味极其敏感,在管道煤气中添加微量乙硫醇,目的是在煤气泄漏时能及时发现,故D不符合题意。
方法点金
根据化学式进行计算
(1) 相对分子质量=相对原子质量与原子个数的积之和。
(2) 组成元素的质量比=相对原子质量与原子个数的积之比(计算时要注意标清元素的顺序)。
(3) 化合物中某元素的质量分数=$\frac{该元素的相对原子质量×原子个数}{该化合物的相对分子质量}×100\%$。
(4) 某元素的质量=某化合物的质量×该元素的质量分数=某化合物的质量×$(\frac{该元素的相对原子质量×原子个数}{该化合物的相对分子质量}×100\%)$。
方法点金
根据化学式进行计算
(1) 相对分子质量=相对原子质量与原子个数的积之和。
(2) 组成元素的质量比=相对原子质量与原子个数的积之比(计算时要注意标清元素的顺序)。
(3) 化合物中某元素的质量分数=$\frac{该元素的相对原子质量×原子个数}{该化合物的相对分子质量}×100\%$。
(4) 某元素的质量=某化合物的质量×该元素的质量分数=某化合物的质量×$(\frac{该元素的相对原子质量×原子个数}{该化合物的相对分子质量}×100\%)$。
查看更多完整答案,请扫码查看


